
Inhibiotry, które leczą raka
Kinazy są enzymami odpowiadającymi za procesy przekazywania informacji wewnątrz komórek. Biorą one także udział w szeregu procesów metabolicznych. Wiele z nich działa niczym specyficzne molekularne przełączniki, co pozwala na aktywację różnych białek w odpowiedzi na zróżnicowane bodźce zewnętrzne i wewnętrzne. Kinazy tworzą skomplikowane sieci zależności, tzw. szlaki przekazywania sygnału, nawzajem włączając bądź wyłączając swoją aktywność. W ten specyficzny sposób współpracujące ze sobą kinazy regulują ekspresję genów oraz aktywność szeregu białek w zależności od aktualnych potrzeb fizjologicznych. Umożliwia to optymalne wykorzystanie dostępnych zasobów oraz prawidłowy rozwój i wzrost komórek.
W komórkach nowotworowych niektóre z kinaz wykazują nadmierną aktywność, w konsekwencji przyczyniając się do niekontrolowanego wzrostu nowotworu i jego rozprzestrzeniania w organizmie. Zaobserwowano, że w wielu typach nowotworów zahamowanie aktywności wybranych kinaz niesie za sobą korzystny efekt terapeutyczny, dlatego też białka te są interesującym celem badań współczesnej biotechnologii.
Inhibitory kinaz leczą raka
Jedną z nowoczesnych metod leczenia chorób nowotworowych jest terapia z wykorzystaniem specjalnych inhibitorów – związków hamujących aktywność kinaz. Sukces pierwszych wprowadzonych na rynek inhibitorów kinaz sprawił, iż badania nad tymi związkami rozwijają się dynamicznie, dając nadzieję na dalsze polepszenie skuteczności terapii. Poznanie dokładnej struktury kinaz na poziomie pojedynczych atomów ułatwia projektowanie wysoce specyficznych i skutecznych inhibitorów oraz pozwala na opisanie molekularnych mechanizmów działania znanych już leków, na przykład celem modyfikacji zakresu ich działania.
Badania prowadzone przez naukowców z UJ mają na celu zarówno określenie struktur kinaz z obecnie znanymi inhibitorami, jak również określenie budowy tych kinaz, których struktury wciąż jeszcze nie poznano. Umożliwi to późniejsze komputerowe zaprojektowanie cząsteczek doskonale wpasowujących się w miejsce aktywne i – po związaniu się z nim – blokujących nadmierną aktywność danej kinazy, a tym samym hamujących lub ograniczających niekontrolowany wzrost komórek nowotworowych. Metoda ta, z powodzeniem wykorzystywana przy odkrywaniu nowych leków, zwana jest „projektowaniem leków w oparciu o strukturę białka" (ang. structure based drug design).
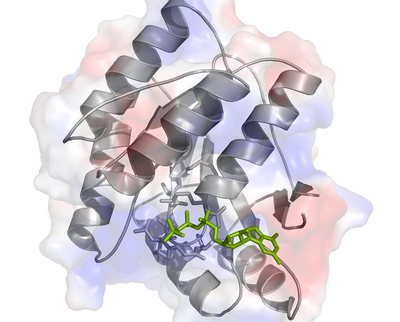
Struktura białka z inhibitorem zaznaczonym na zielono
Promieniem w kryształ białka
Do poznania struktury białek wykorzystuje się krystalografię rentgenowską, metodę pozwalającą w pośredni sposób, przy pomocy promieniowania rentgenowskiego, opisać strukturę molekuł budujących sieć krystaliczną. O tym, jak potężnym narzędziem badawczym jest krystalografia rentgenowska świadczy fakt, iż od początku XX wieku Nagrodę Nobla za badania związane z krystalografią przyznano 26 razy, a wśród nich jedną z najważniejszych była ta przyznana za odkrycie struktury DNA przez Watsona, Cricka i Wilkinsa.
Makromolekuły, takie jak białka czy kwasy nukleinowe, umieszczone w odpowiednim środowisku chemicznym, tworzą kryształy wielkości kilkudziesięciu mikrometrów. Charakterystyczne dla kryształów jest to, że zbudowane są z ogromnej liczby symetrycznie uporządkowanych cząsteczek białka, które zorganizowane są w gęstą, regularną sieć. Taka budowa kryształu umożliwia załamanie się wysokoenergetycznego promieniowania rentgenowskiego, a ze sposobu, w jaki promieniowanie jest rozpraszane na krysztale, naukowcy potrafią wyliczyć dokładne położenie poszczególnych atomów budujących białko.
W codziennej pracy badawczej wykorzystywane są stosunkowo słabe laboratoryjne źródła promieniowania rentgenowskiego. Ogromne możliwości współczesnej krystalografii odkrywają jednak dopiero źródła synchrotronowe – np. powstający na terenie III Kampusu UJ synchrotron „Solaris". Synchrotrony to bardzo skomplikowane i niezwykle kosztowne instalacje badawcze wykorzystywane w krystalografii białek, ale także w bardzo wielu innych dziedzinach, np. w fizyce lub materiałoznawstwie. W znacznym uproszczeniu jest to długi, zamknięty tunel, w którym w wysokiej próżni krążą elektrony rozpędzone do prędkości bliskiej prędkości światła. W takich warunkach generowane jest promieniowanie obejmujące m.in. promieniowanie rentgenowskie, którego wiązkę kieruje się bezpośrednio na kryształ białka. Odpowiednie, czułe detektory zbierają informacje o załamanych promieniach, które później są komputerowo przetwarzane, ukazując strukturę białka. Ponieważ w Polsce wciąż nie istnieją odpowiednie źródła promieniowania synchrotronowego, podczas dotychczasowych badań nad strukturą białek, prowadzonych przez naukowców z UJ, wykorzystywane były urządzenia znajdujące się w innych krajach europejskich. Zakończenie budowy Narodowego Centrum Promieniowania Synchrotronowego „Solaris" pozwoli krystalografom z UJ na jeszcze efektywniejsze zgłębianie struktur zarówno kinaz, jak i innych białek.
Badania nad strukturą kinaz biorących udział w procesach nowotworowych są nowym projektem badawczym na UJ. Pierwszym wymiernym sukcesem projektu był współudział w badaniach, które wyjaśniły rolę glukokinazy w nadmiernie dzielących się białych krwinkach. Badania są kontynuowane we współpracy z naukowcami z Niemieckiego Centrum Badań nad Rakiem w Heidelbergu oraz badaczami ze Szpitala Dziecięcego św. Judy w Memphis (Stany Zjednoczone) i mają na celu m.in. scharakteryzowanie struktury molekularnej tego białka, co być może w przyszłości pozwoli na stworzenie nowoczesnych leków, m.in. na białaczkę.
Projektor Jagielloński 2, "Inhibitory kinaz leczą raka", www.projektor.uj.edu.pl



Najdokładniejsze systemy satelitarnego transferu czasu
Nie zawsze zegar atomowy działa lepiej niż kwarcowy.

Ponad połowa chorych z SARS-CoV2 cierpi na długi covid
Przez długi czas może mieć takie objawy jak zmęczenie.



Uniwersytet Warszawski będzie kształcić kadry dla energetyki jądrowej
Przekazał Wydział Fizyki UW.










Recenzje