- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Systemy dostarczania leków w medycynie
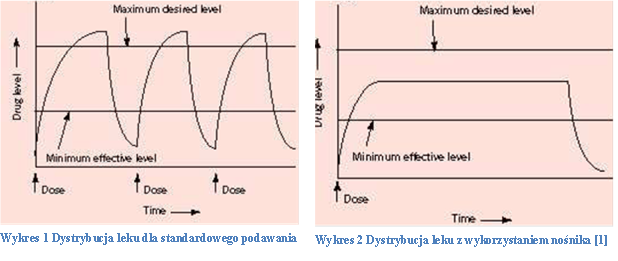
Praktyczne wykorzystanie nośników leków w medycynie ma duże perspektywy i już w tej chwili cieszą się dużą popularnością, o czym świadczy fakt, że w 2003 roku po raz pierwszy w historii w USA dopuszczono do obrotu rynkowego więcej produktów biotechnologicznych niż konwencjonalnych niskocząsteczkowych leków. Niniejszy artykuł opisuje różne sposoby dostarczania leków.
1. Koniugaty nośnik-lek
Koniugaty to kompleksy, które zawierają nośniki leków, z którymi lek wiązany jest zazwyczaj za pomocą wiązania kowalencyjnego. Mozliwe jest również wykorzystanie jako substancji czynnej zamiast leku białek, peptydów czy też DNA. Jako makrocząsteczki stosuje się polimery naturalne lub syntetyczne, ale można się również spotkać z białkami i przeciwciałami. Wiązaniu leku z nośnikiem często towarzyszy zmiana jego dystrybucji, która jest korzystna jeśli następuje jego zwiększona kumulacja w tkance docelowej. Biodystrybucja związanego leku zależy od właściwości nośnika. Można wyróżnić dwa podejścia do dostarczania leków: aktywne i bierne.
W transporcie aktywnym jako nośniki lub jego fragmenty wykorzystuje sie swoiste przeciwciała cukry, peptydy lub białka, które mogą wybiórczo wiążąc się z receptorami lub antygenami komórek docelowych. Skutkuje to większym stężeniem leku w tkankach docelowych niż w przypadku podawania wolnego leku. Mimo, że są to bardzo perspektywiczne koniugaty nie są jeszcze dostępne na rynku, a badania nad nimi, nie są jeszcze dobrze rozwinięte.
Transport pasywny stosowany jest głównie w leczeniu nowotworów. Wykorzystuje się tutaj unikalną anatomiczną i fizjologiczną charakterystykę tkanki guza nowotworowego przede wszystkim zwiększoną przepuszczalność naczyniową (EPR) i zatrzymywanie małych i dużych cząsteczek w tkance guza nowotworowego. Tkanki nowotworowe, w przeciwieństwie do tkanej zdrowych, charakteryzują się często nieszczelną siecią naczyń krwionośnych, powstała w wyniku chaotycznej neoangiogenezy. Średnica tych szczelin szacowana jest na 100-800 nm, a w zdrowych tkankach jest to jedynie 2-6 nm. Większość niskocząsteczkowych leków przeciwnowotworowych posiada niewielki rozmiar i mogą dyfundować do tkanek zdrowych i chorych. Jeśli zastosuje sie koniugaty, których rozmiar jest większy, lek nie wnika do zdrowych tkanek, a jedynie do guzów nowotworowych. Ponadto w tkance nowotworowej często upośledzony jest układ drenażu limfatycznego, co powoduje obniżenie klirensu leku z tkanki nowotworowej i gromadzenie sie makrocząsteczek w guzie. Logiczne więc wydaje się być to, że o stopniu gromadzenia się makrocząsteczek w tkance nowotworowej decyduje ich wielkość, która powinna przekraczać 20 kDa. Na EPR ma wpływ również stopień unaczynienia guza. Transport pasywny wykorzystuje się również do leczenia tkanek objętych stanem zapalnych np. reumatoidalne zapalenie stawów i inne choroby o podłożu reumatoidalnym, w których również występuje EPR. Istotne jest również to, że masa cząsteczkowa może wpływać na biologiczny okres półtrwania. Jeśli przekracza ona próg nerkowy, czyli 40 kDa następuje obniżenie klirensu nerkowego koniugatu i zostaje on dłużej w układzie krwionośnym, przez co jego kumulacja w chorej tkance jest większa. Im większa masa cząsteczkowa tym klirens nerkowy jest bardziej obniżony. Na właściwości farmakokinetyczne i biodystrybucję ma również wpływ ładunek, konformacja, hydrofobowość i immunogenność nośnika.
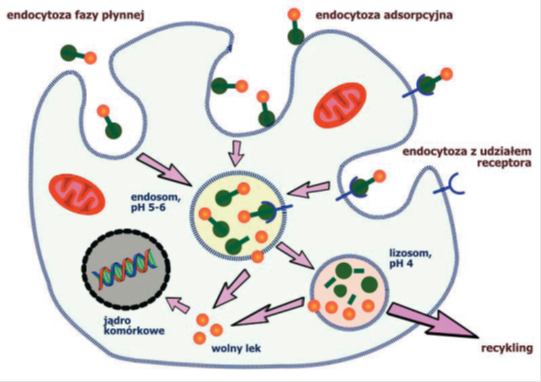
Uwolnienie leku z koniugatu może nastąpić w przestrzeni wewnątrz lub zewnątrzkomórkowej. Wykorzystuje się np. fakt, że guz nowotworowy posiada niższe pH niż zdrowe tkanki i niektóre wiązania mogą ulec zerwaniu w tym środowisku. Innym sposobem jest wykorzystanie degradacji połączenia nośnik-lek w warunkach fizjologicznych. Głównym mechanizmem odpowiedzialnym za przechodzenie makrocząsteczek przez błonę komórkową jest endocytoza fazy płynnej, adsorpcyjna lub z udziałem receptora, schematycznie przedstawiona na rys. 1.
Do nośnika moga być przyłączone cząsteczki tropowe takie jak przeciwciala i cukry, które są odpowiedzialne za rozpoznanie komórek lub tkanek docelowych. Czasami dołącza się również ugrupowania modyfikującego rozpuszczalność koniugatu.
Nośnik w koniugatach powinien spełniać następujące wymagania:
• nietoksyczność
• nieimmunogenność
• biokompatybilność
• nie występowanie kumulacji w organiźmie
• zawiera grupy funkcyjne, umożliwiające przyłączenie leku
• po koniugacji aktywność leku powinna być zachowana
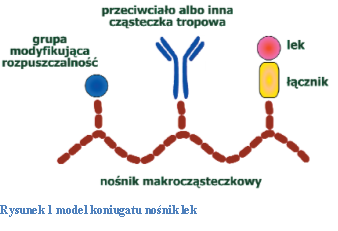
Ogólny model koniugatu nośnik-lek przedstawiony jest na rysunku 2. Jako nośniki stosuje się zwykle polimery syntetyczne jak np. polietylenoglikol (PEG) czy też polikwas glutaminowy (PGA), N-(2-hydroksypropylo)metakryloamid (HPMA). Do innych materiałów na nośniki należą dekstryny i białka należące do naturalnych makrocząsteczek np. albumina. Poniższa tabela zawiera zestawienie dostępnych na rynku preparatów oraz będących w fazie badań na stan 2007 roku........
Pobierz:
Systemy dostarczania leków w medycynie
Tagi: lek, nośnik, biodystrybucja, lab, laboratorium, koniugat, neoangiogeneza, biokompatybilność
wstecz Podziel się ze znajomymi









Recenzje