- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Tomografia emisyjna pojedynczego fotonu w diagnostyce obrazowej
Podstawową techniki SPECT, jest dostarczenie pacjentowi radioizotopu (radionuklidu) będącego emiterem promieniowania gamma, zazwyczaj przez wstrzyknięcie do krwioobiegu. Zdarza się czasami że stosowany radioizotop występuje w postaci prostych jonów rozpuszczalnych w wodzie. Jednakże w większości przypadków, radioizotopy w SPECT są tylko znacznikami związanymi z określonymi ligandami (nośnikami), które to wykazują specyficzne właściwości selektywnego wiązania się z receptorami bądź epitopami przeciwciał linii komórek nowotworowych (Rys. 1).
Diagnostyka obrazowa jest nieinwazyjną metodą mającą na celu ocenę choroby lub stanów chorobowych i monitorowania skutków jej leczenia.
Ogólnie rzecz biorąc, radiofarmaceutyk diagnostyczny, który wprowadzany jest do ciała pacjenta w bardzo niskich stężeniach (w zakresie od nano- do piko molowych) nie ma na celu działania farmakologicznego. Radionuklid wybierany do obrazowania diagnostycznego opiera się głównie na dwóch zasadniczych technikach radioobrazowania. Mianowicie na tomografii emisyjnej pojedynczego fotonu (SPECT) oraz pozytonowej tomografii emisyjnej (PET). Oba ugruntowane klinicznie sposoby obrazowania umożliwiają dotarcie do tkanek głęboko położonych. Zarejestrowane promieniowanie o różnym natężeniu odpowiadającym poziomom stężeń radioizotopu w tkance poddawane jest następnie obróbce komputerowej, dzięki której możliwe będzie stworzenie rzeczywistego obrazu badanego organu. Na podstawie wygenerowanego obrazu można określić w jaki sposób dany organ lub układ działa (Rys. 3).
Rysunek 3. Obraz SPECT przedstawiający nowotwór mózgu - glejaka wielopostaciowego zobrazowany przy zastosowaniu radiofarmaceutyku 99mTc-Tetrofosmin [3].
Techniki obrazowania w tomografii emisyjnej
Technika SPECT dała podwaliny pod nowsze rozwiązania techniczne w diagnostyce obrazowej. Takim rozwiązaniem jest technika PET, w której wykorzystano radiofarmaceutyki znakowane krótkożyjącymi izotopami emitującymi pozytony. Emiterami pozytonów są radionuklidy rozpadające się zgodnie z mechanizmem beta plus. W wyniku takiego rozpadu powstaje pozyton, który oddziałuje z pierwszym napotkanym elektronem. Efektem oddziaływania (anihilacji) jest powstanie dwóch fotonów o energii 511 keV każdy. Powstałe fotony rozchodzą się w ośrodku po linii prostej w kierunkach do siebie przeciwnych. Detektor PET w kształcie pierścienia otaczającego badanego pacjenta precyzyjnie określa ich źródło i przekazuje do jednostki przetwarzania obrazu na obrazy PET poprzez matematyczne procedury rekonstrukcji (Rys. 4).
Radionuklidy stosowane w PET, takie jak fluor-18, węgiel-11, azot-13 oraz tlen-15, są powszechnie używane w badaniach zarówno klinicznych jak i podstawowych. Mają one jednak wysokie ceny ze względy na bardzo krótki czas połowicznego rozpadu i przez to konieczność produkcji cyklotronowej.
Detektory
W wyniku zastosowania fotopowielacza może nastąpić integracja wielu takich kaskadowo wzmocnionych sygnałów, które ostatecznie zostaną przetworzone przez komputerowy system do rekonstrukcji obrazów SPECT.
Radiofarmaceutyki SPECT
Przy projektowaniu radiofarmaceutyków SPECT potencjalne zastosowanie mają trzy radioizotopy będące emiterami promieniowania gamma o niskiej energii. Mowa tu o technecie-99m (99mTc), indzie-111 (111In) oraz galu-67 (67Ga). Prawie 80 % wszystkich radiofarmaceutyków diagnostycznych SPECT stosowanych w badaniach klinicznych znakowane jest 99mTc z powodu jego łatwej dostępności (produkowany generatorowo), optymalnych właściwości radiochemicznych oraz niskich kosztów. Pozostałe znakowane są indem-111. Natomiast gal-67 zajmuje marginalna pozycję.
W tabeli poniżej zestawiono najczęściej stosowane w medycynie nuklearnej radiofarmaceutyki SPECT wraz z ich przeznaczeniem aplikacyjnym.
Tabela 1. Wybrane radiofarmaceutyki najczęściej stosowane w dzisiejszej diagnostyce obrazowej CPECT [4]. Zmienione.
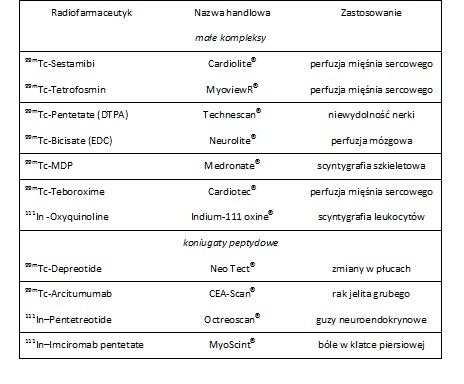
Technet-99m należy do siódmej grupy układu okresowego. 99mTc (t1/2 = 6,01 h) jest metastabilnym izotopów promieniotwórczych emitującym promieniowanie gamma (fotony) o energii 143 keV. Radioizotop ten rozpada się na bardzo stabilnych siostrzany izotop 99Tc. Czas półtrwania izotopu technetu-99m (t1/2 = 6,01 h) jest wystarczający do właściwego przygotowania procedury skanowania radiofarmaceutyku SPECT i jest na tyle krótki, by zachować na niskim poziomie całkowitą dawkę jaką przyjmuje pacjent podczas ekspozycji. 99mTc otrzymywany jest w postaci jonów 99mTcO4- z generatora radionuklidów 99Mo/99mTc. Wyjściowy radionuklid generatora technetu-99m, którym jest molibden-99 (t1/2 = 2,78 dni) stanowi produkt rozszczepienia uranu-235. W generatorze 99Mo/99mTc, jony 99mTcO4- są tworzone w wyniku rozpadu 99MoO42-. 99mTcO4- (wysoka aktywność właściwa) wymywany jest z kolumny chromatograficznej połączonej z generatorem za pomocą soli fizjologicznej. Całkowite stężenie technetu w eluencie generatorowym 99Mo/99mTc zawiera się w zakresie 10-7 - 10-6 molxL-1.
Ze względu na krótki okres półtrwania, większość radiofarmaceutyków opartych na 99mTc jest prostymi kompleksami metalu lub koniugatami metalu z krótkimi peptydami lub białkami.
Historycznie pierwszy generator 99Mo/99mTc został opracowany w latach pięćdziesiątych XX wieku przez Brookhaven National Laboratory, który zrewolucjonizował badania radiofarmaceutyczne opierające się na 99mTc Badania zostały przyspieszone, aby w latach osiemdziesiątych kupić się głównie na produkcji małych kompleksów 99mTc jako radioznaczników perfuzji serca i mózgu. Szeroko zakrojone badania koordynacyjnej chemii technetu-99m doprowadziły do pomyślnego rozwoju wielu nośników 99mTc pierwszej generacji, które są znane jako podstawowe czynniki technetu.
W 1981 roku odkryto jeden z najbardziej istotnych podstawowych czynników 99mTc, o nazwie [99mTc (MIBI)6]+ (MIBI: 2-metoksy-2-metylpropylisonitryl), który gromadził się w tkankach sercowych po podaniu dożylnym. Związek ten znany jest pod nazwą handlową Cardiolite lub Sestamibi. Otrzymany koniugat pomaga w ocenie ilości krwi przepływającej przez mięsień sercowy w warunkach spoczynku oraz stresu. Wykorzystanie koniugatu jest szerokie, gdyż można go podać zarówno ludziom, którzy już mają objawy ataku serca, ale również ludziom, którzy są w grupie ryzyka, lecz nie wykazali oznak. Prócz Sestamibi dostępny jest w handlu inny środek obrazowania perfuzji mięśnia sercowego, a mianowicie 99mTc-Tetrofosmin o nazwie [99mTcO2(tetrofosmin)2]+ (tetrofosmin: 1,2-bis[bis(2-etoksyetylo)fosfinoetan) (Tab. 1).
Radioizotop galu-67
Gal-67 występuje w postaci silnie kwaśnych kationów na plus trzecim stopniu utlenienia (67Ga3+). Gal-67 korzystnie wiąże się z chelatorami zawierającymi anionowe grupy funkcyjne (DFO, DOTA, DTPA). Radionuklid wytwarzany jest w cyklotronie metodą protonowego bombardowania natywnej tarczy cynkowej (natZn). Produkcja izotopu 67Ga trwa w granicach 15-20 godzin. Radionuklid o wysokiej czystości izolowany jest z tarczy przez rozpuszczenie i chromatografię z wykorzystaniem organicznych żywic polimerowych zawierających groupy niewymienne z jonami.
67Ga (t1/2 = 78,3 h) rozpada się na stabilny 67Zn przez wychwytywania elektronów (ang. elektron capture) i jest szeroko stosowany w medycynie jądrowej. Chociaż koniugat 67Ga(III) z cytrynianem nie jest związkiem specyficznym dla konkretnego nowotworu, to koncentruje się w wielu typach guzów i niezłośliwych zmianach chorobowych, zwłaszcza zapalnych.
Ogólnie rzecz biorąc, 67Ga(III)-cytrynian wiąże w osoczu krwi transferyny i następnie transportowany jest do tkanek nowotworowych.
Przy zastosowaniach immunologicznych SPECT, 67Ga skoniugowany jest z przeciwciałami monoklonalnymi poprzez desferoksyaminę (DFO) lub kwas 1,4,7,10-tetraazacyklododekano-1,4,7,10-tetraoctowy (DOTA) bez utraty zdolności wiązania antygenu (Rys. 6).
Radioizotop Indu-111
Mimo tego, że w handlu dostępne są pewne małe kompleksy 111In do SPECT, to radiometal ten przede wszystkim stosowany jest do opracowywania koniugatów z przeciwciałami monoklonalnymi do obrazowania SPECT. Najczęstszym stosowanym sposobem wiązania 111In do przeciwciała jest wykorzystanie chelatorów dwufunkcyjnych. Najbardziej opłacalnym chelatorem dla 111ln są pochodne DTPA.
W przeszłości większość badań immuno-SPECT przeprowadzano stosując jako źródło promieniotwórcze jod-131 (radionuklid niemetaliczny). Badania porównawcze pomiędzy 131I i 111ln wykazały, że ind dociera do nowotworów poprzez krew o wiele szybciej. Poza tym posiada dłuższy czas retencji radioaktywności w guzie, co przekłada się na jaśniejsze obrazy. Istnieją jednak znaczne niedogodności związane z użyciem 111In. Główną wadą jest wysoki niespecyficzny wychwyt radiometal w wątrobie, nerkach i śledzionie pacjenta. Wyeliminowanie tego problemu jest obecnie głównym nurtu badań radiochemicznych dla tego radioizotopu.
Ostatnio, trzy przeciwciała znakowane indem-111 (ProstaScint, OncoScint i MyoScint) zostały zatwierdzone do stosowania u ludzi. Wszystkie trzy zatwierdzone radiofarmaceutyki wykorzystują do kompleksowania indu-111 dwufunkcyjnego chelatora DTPA. Przeciwciało o nazwie handlowej ProstaScint skierowane jest na specyficzny błonowy antygen prostaty (PMSA), którego nadekspresję stwierdzono w komórkach gruczolakoraka prostaty. OncoScint lokalizuje lub wiąże się specyficznie z glikoproteinami błonowymi komórek nowotworowych TAG-72 gruczolakoraka jelita grubego i jajnika. MyoScint wiąże się z komórkami mięśnia sercowego, co pozwala obrazować jego zawał.
Podsumowanie
Autor: Karolina Wójciuk
1. Eberle, A.N., Mild, G., Froidevaux, S., 2004. Receptor-Mediated Tumor Targeting with Radiopeptides. Part 1. General Concepts and Methods: Applications to Somatostatin Receptor-Expressing Tumors. J. Recept. Signal Transduct. Res. 24(4), 319-455.
2. http://withfriendship.com/user/sathvi/single-photon-emission-computed-tomography.php
3. Alexiou ,G.A., Tsiouris, S., Kyritsis, A.P., Fotakopoulos, G., Goussia, A., Voulgaris, S., Fotopoulos, A.D., 2010. The value of 99mTc-tetrofosmin brain SPECT in predicting survival in patients with glioblastoma multiforme. J. Nucl. Med. 51(12), 1923-6.
4. Bhattacharyya, S., Dixit, M., 2011. Metallic radionuclides in the development of diagnostic and therapeutic radiopharmaceuticals. Dalton Trans. 40(23), 6112-28.
5. Madsen, M.T., 2007. Recent advances in SPECT imaging. J. Nucl. Med. 48(4), 661-673.
Tagi: tomografia, foton, obrazowanie, diagnostyka, promieniowanie gamma, radionuklid, radioizotop, radiofarmaceutyk, detekcja, emiter gamma, koniugat, powinowactwo receptorowe
wstecz Podziel się ze znajomymi









Recenzje