- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Chromatografia wykorzystująca hydrofobowe właściwości cząsteczek: chromatografia fazy odwróconej cz. II
 Zarówno paracetamol, teofilina jak i salicylany moga być w łatwy sposób ekstrahowane z osocza, dzięki czmu możliwe jest określenie ich stężenia w osoczu. Ekstrakcję tych leków prowadzi się przy zastosowaniu mieszaniny chlorek metylenu/propanol występujących w stosunku 9:1.
Zarówno paracetamol, teofilina jak i salicylany moga być w łatwy sposób ekstrahowane z osocza, dzięki czmu możliwe jest określenie ich stężenia w osoczu. Ekstrakcję tych leków prowadzi się przy zastosowaniu mieszaniny chlorek metylenu/propanol występujących w stosunku 9:1.Analityczne metody oznaczania leków w płynach fizjologicznych
Wykonanie:
1) Przygotowanie próbek do chromatografii: ekstrakcja leków
Na początku należy przygotować mieszaninę ekstrakcyjną wg przepisu: chlorek metylenu/2-propanol w stosunku 9:1, z dodatkiem wewnętrznego standardu (8-C1-tefilina) o stężeniu 7µM. Z kontrolnego oscza, tj. wolnego od leków przygotować osocze wzorcowe w objętości 1 ml, zawierające: paracetamol (w stężeniu 0,4 mM) , teofilinę (75µM) oraz salicylan ( 1 mM). Równolegle należy prowadzić ekstrakcję trzech próbek , tj:
1) Osocza wolnego od leków
2) Osocza wzorcowego oraz
3) Osocza, które zawiera nieznaną ilośc leków.
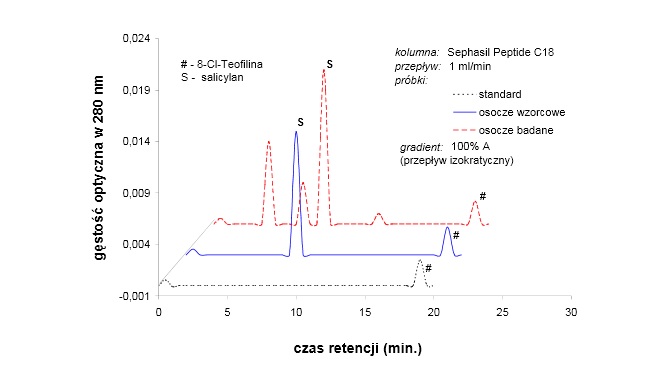
1) Analiza zawartości leków w próbkach
W próbce, która jest wolna od leków powinien pojawić się tylko wewnętrzny standard czyli 8-Cl-teofilina . Czas retencji dla tej próbki to ok. 19 min.
- paracetamolowi (ok. 4 min)
- teofilinie (ok. 7 min)
- oraz salicylanowi (ok. 8 min).
Gdzie:
C leku i C wzorca leku – stężenia badanego leku, odpowiednio w osoczu badanym i wzorcowym;
A leku próby i A leku wzorca – zmierzone wartości maksymalnej absorbancji w szczycie badanego leku, odpowiednio w próbie badanej i wzorcowej;
Po zakończeniu rozdziału chromatograficznego i oznaczeń, kolumnę należy przemyć 20% metanolem w objętości 30 ml i przechowywać kolumnę w temperaturze pokojowej. Kolumna musi być przechowywana szczelnie zamknięta ( z obu końców) lub podłączona do systemu HPLC [1], [2].
Szikonina i jej pochodne wykazują również aktywność antybakteryjną. Działanie takie odnosi się zarówno do bakterii Gram-dodatnich (G+), np. Staphylococcus aureus [7], [8], jak również bakterii Gram-ujemnych(G-) w tym Escherichia coli i Pseudomonas aeruginosa (Karyagina et al., 2001). Inny barwnik: plumbagina- wykazuje działanie przeciwko Helicobacter pylori [9].
W przypadku zastosowania wysokosprawnej chromatografii cieczowej w odwróconym układzie faz , jako fazę stacjonarną stosuje się żel krzemionkowy, który poddawany jest modyfikacji z wykorzystaniem grup oktadecylowych. W większości stosowanych metodyk rozdzielania związków wykorzystuje się elucję izoakratyczną , gdzie eluentem jest wodny roztwór acetonitrylu lub metanolu, z dodatkiem kwasu octowego bądź mrówkowego.
Do detekcji związków należących do grupy naftochinonów powszechnie wykorzystuje się detektory spektrofotometryczne UV-VIS ( z matrycą fotodiodową – DAD, lub z detektorem fluorescencyjnym).
Zastosowanie elucji izokratycznej pozwala na łatwiejsze odzyskanie składników eluentu, a ponadto wpływa na bardzo ważny aspekt całej metodyki: czyni zaprojektowany proces rozdzielczy bardziej ekonomicznym [16].
Autor: Lidia Koperwas
Literatura:
[1]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 172 – 176
[2]. http://www.biofizyka.p.lodz.pl/ch7.pdf
[3]. Kohlmünzer S. (2007). Farmakognozja. Podręcznik dla studentów farmacji. Wyd. V unowocześnione. PZWL, Warszawa: 150-198, 253-277, 377-379, 531
[4]. Papageorgiou V.P., Assimpoulou A.N., Couladouros E.A., Hepworth D., Nicolaiu K.C. (1999). The chemistry and biology of alkannin, shikonin and related naphthazarin natural products. Angewandte Chemie International Editio, 38: 270-300
[5]. Wang W.J., Bai J.Y., Liu D.P., Xue L.M., Zhu X.Y. (1994). The antiinflammatory activity of shikonin and its inhibitory effect on leukotriene B4 biosynthesis. Yaoxue Xuebao, 29: 161-165
[6]. Nam K.N., Son M.-S., Park J.-H., Lee E.H. (2008). Shikonins attenuate microglial inflammatory responses by inhibition of ERK, Akt, and NF-κB: neuroprotective implications. Neuropharmacology, 55 (5): 819825
[7]. Shen C.C., Syu W.J., Li S.Y., Lin C.H., Lee G.H., Sun C.M. (2002). Antimicrobial activities of naphthazarins from Arnebia euchroma. Journal of Natural Products, 65(12): 1857-1862
[8]. Pietrosiuk A., Kędzia B., Hołderna-Kędzia E., Wiedenfeld H., Malinowski M., Furmanowa M. (2003). Antimicrobial activity of naphthoquinones from Lithospermum canescens Lehm. Herba Polonica, 49(3/4): 209-215
[9]. Wang Y.-C., Huang T.-L. (2005). High-performance liquid chromatography for quantification of plumbagin, an anti-Helicobacter pylori compound of Plumbago zeylanica L. Journal of Chromatography A, 1094: 99–104
[10]. Ho T.Y., Wu S.L., Lai I.L., Cheng K.S., Kao S.T., Hsiang C.Y. (2003). An in vitro system combined with an in-house quantitation assay for screening hepatitis C virus inhibitors. Antiviral Research, 58: 199-208
[11]. Chen X., Yang L., Hang N., Turbin J.A., Buckheit R.W., Sterling C., Oppenheim J.J., Howard O.M.Z. (2003a). Shikonin, a component of Chinese herbat medicine, inhibits chemokine receptor function and suppresses Human Immunodeficiency Virus type 1. Antimicrobial Agents and Chemotherapy, 47(9): 2810-2816
[12]. Sankawa U., Otsuka H., Kataoka Y., Iitaka Y., Hoshi A., Kuretani K. (1981). Antitumor activity of shikonin, alkannin and their derivatives. II. X-Ray analysis of cycol-alkannin leucoacetate, tautomeriom of alkannin and cycol-alkannin and antitumor activity of alkannin derivatives. Chemical & Pharmaceutical Bulletin, 29(1): 116-122
[13]. Ahn B.Z., Baik K.U., Kreon G.R., Lim K., Hwang B.D. (1995). Acylshikonin analogues: synthesis and inhibition of DNA topoisomerase-I. Journal of Medicinal Chemistry, 38: 1044-1047
[14]. Gao D., Hiromura M., Yasui H., Samurai H. (2002). Direct reaction between shikonin and thiols induces apoptosis in HL60 cells. Biological and Pharmaceutical Bulletin, 25(7): 827-832
[15]. http://biuletynfarmacji.wum.edu.pl/1101Bolonkowska/Bolonkowska.html
[16]. Boczkaj G., Jaszczołt G., Leman A., Skrzypczak A., Królicka A., Kamińska M.,2011. Zastosowanie cgromatografii cieczowej w odwróconym układzie faz (RP-LC) w rozdzielaniu i oznaczaniu polifenoli i naftochinonów w materiałąch roślinnych. Camera Separatoria (previously Postępy Chromatografii), Volume 3, Numer 1/June 2011 , 87-99. http://dach.ich.uph.edu.pl/cs/download/cs_vol3_no1/_cs_2011_87-100.pdf
Tagi: teofilina, paracetamol, salicylany, ekstrakcja, chromatografia fazy odwróconej, naftochinony, lab, laboratorium
wstecz Podziel się ze znajomymi









Recenzje