- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Zastosowanie wektorów białkowych w medycznych technikach przeciwnowotworowych
Wprowadzenie
Zarówno przeciwciała, jak i białka regulatorowe naturalnie występują w organizmach ssaków, gdzie pełnią ściśle określone funkcje. Przeciwciała są dużo cięższe od białek i w przeciwieństwie do nich nie wiążą się tylko ze specyficznymi receptorami białkowymi ale też z innymi swoistymi epitopami zlokalizowanymi na błonach komórkowych.
Radiofarmaceutyki stosowane w diagnostyce i terapii medycznej
Najbardziej znanym i często stosowanym w terapii emiterem beta minus jest otrzymywany w reaktorze jądrowym jod-131. W terapii tarczycy jest on stosowany w formie roztworu Na131I. Izotop jodu-131 przyłączany jest również do nośników peptydowych stosowanych obecnie w diagnostyce antynowotworowej. Ze względu na emitowane dodatkowo przez ten radionuklid promieniowanie gamma, w łatwy sposób można stwierdzić jego umiejscowienie za pomocą kamer gamma mieszczonych na zewnątrz ciała pacjenta.
Innym radioizotopem stosowanym w terapii jest otrzymywany w reaktorze jądrowym izotop lutetu-177, który emituje beta minus krótkiego zasięgu. Podobnie jak jod-131 emituje on również promieniowanie, przez co staje sie również znakomitym izotopem diagnostycznym.
Radionuklidy stosowane w diagnostyce radioizotopowej to głównie emitery promieniowania gamma, takie jak 99mTc, 111In, 67Ga oraz 123I. Znalazły one szerokie zastosowanie w technice SPECT. Technika SPECT opiera się na detekcji promieniowania gamma emitowanego przez wprowadzony do ciała pacjenta radioizotop. Wygenerowany w tej technice obraz jest trójwymiarowy i obrazuje miejsca koncentracji zmian nowotworowych.
Somatostatyna
Somatostatyna jest hormonem peptydowym, który wpływa na przekaźnictwo nerwowe, proliferację komórek oraz stymuluje uwalnianie licznych hormonów (Rys. 1). Istnieje sześć różnych genów somatostatyny, przy czym u człowieka występuje tylko jeden [3]. Somatostatyna posiada szeroki zakres funkcji w organizmie ze względu na ekspresję aż pięciu podtypów receptora sst (sst1-5) [4]. Nadekspresję receptorów somatostatyny zlokalizowano w guzach neuroendokrynowych (gruczolaki przysadki wydzielające GH, guzy przewodu pokarmowego, guzy chromochłonne, nerwiaki niedojrzałe, nowotwory tarczycy, drobnokomórkowy rak płuc), guzy mózgu (oponiaki, glejaki), chłoniaki, nowotwory nerki, piersi, prostaty, jajników oraz żołądka [1].
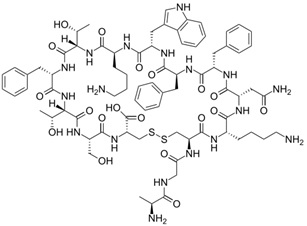
Rysunek 1. Budowa somatostatyny SS14 [5].
Gastryna
Gastryna jest hormonem peptydowym (Rys. 2), który pobudza wydzielanie kwasu żołądkowego (HCl) przez komórki okładzinowe żołądka oraz substancji pomocniczych w perystaltyce żołądka [6]. Gastryna wykazuje swoiste powinowactwo do receptora CCK2, którego nadekspresję stwierdzono w drobnokomórkowym raku płuc, nowotworach piersi i jajników oraz w guzach z komórek macierzystych różnego pochodzenia [1].
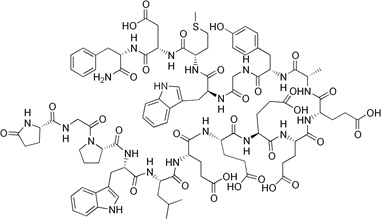
Rysunek 2. Budowa gastryny [7].
Bombezyna
Bombezyna jest peptydem zbudowanym z czternastu aminokwasów połączonych liniowo [8]. U ssaków peptyd ten występuje w postaci dwóch homologów, mianowicie jako neuromedyna B oraz peptyd uwalniający gastrynę (GRP). Bombezyna stymuluje uwalnianie gastryny z komórek G.
Wykazuje swoiste powinowactwo do receptora BB, który występuje w czterech podtypach (BB1-4). Nadekspresję receptora bombezyny stwierdzono w drobnokomórkowym raku płuc, raku żołądka, piersi oraz prostaty [1] (Rys. 3).
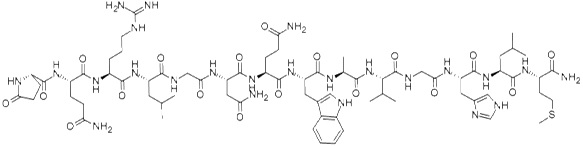
Rysunek 3. Budowa bombezyny [9].
Neurotensyna
Neurotensyna to neuropeptyd zbudowany z trzynastu aminokwasów. Bierze on udział w regulacji uwalniania hormonu luteinizującego i prolaktyny. Neurotensyna jest rozprowadzona w ośrodkowym układzie nerwowym. Dodatkowo zaangażowana jest w regulację szlaków dopaminowych.
Neurotensyna znajduje się również w komórkach endokrynowych jelita cienkiego, gdzie stymuluje skurcze mięśni gładkich [10]. Neuropeptyd wykazuje swoiste powinowactwo do receptora NTR, który z kolei występuje w trzech podtypach (NTR1-3). Nadekspresję receptora neurotensyny stwierdzono w drobnokomórkowym raku płuc, raku piersi, okrężnicy, odbytnicy, gruczołu krokowego, jajników, nerek, wątroby, guzach neuroendokrynowych jelita, gruczolakach przysadki, nerwiaku niedojrzałym oraz chłoniakach [1] (Rys.4).
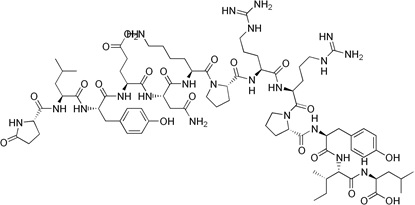
Rysunek 4. Budowa neurotensyny [11].
Substancja P
Substancja P jest neuropeptydem zbudowanym z jedenastu aminokwasów, który pełni funkcję zarówno neuroprzekaźnikową, jak i neuromodulatorową. Substancja P jest uwalniana przez zakończenia nerwów czuciowych. Występuje w mózgu i rdzeniu kręgowym. Związana jest z powstawaniem procesów zapalnych i bólu. Neuropeptyd wykazuje swoiste powinowactwo do receptora NK, który występuje w trzech podtypach (NK1-3) [12]. Nadekspresję receptora substancji P stwierdzono w nowotworach glejowych, rakach tarczycy, raku płuc, raku trzustki oraz piersi (Rys. 5).
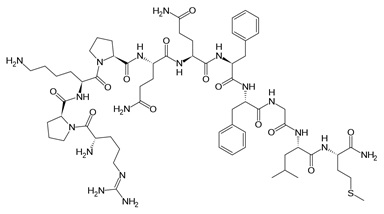
Rysunek 5. Budowa substancji P [13].
Hormon stymulujący melanocyty alfa (α-MSH)
Rysunek 6. Budowa hormonu α-MSH [15].
Wazoaktywny peptyd jelitowy (VIP)
VIP to hormon peptydowy zbudowanym z dwudziestu ośmiu reszt aminokwasowych. Neuropeptyd wytwarzany jest w wielu tkankach takich jak jądra, jelita i trzustka [16]. VIP stymuluje skurcze mięśnia sercowego, rozszerzalność naczyń krwionośnych, zwiększa glikogenolizę, obniża ciśnienie tętnicze krwi i rozluźnia mięśnie gładkie tchawicy. Wykazuje swoiste powinowactwo do receptora VPAC, który występuje w postaci dwóch podtypów, mianowicie VPAC1 oraz VPAC2 (Rys. 7).
Rysunek 7. Budowa wazoaktywnego peptydu jelitowego [17].
Peptyd aktywujący cyklazę adenylanową przysadki (PACAP)
PACAP jest białkiem podobnym do wazoaktywnego
peptydu jelitowego [18]. Jednym z efektów jego działania jest stymulowanie
enterochromaffin. PACAP wykazuje swoiste powinowactwo do receptora PAC1,
którego nadekspresję wykryto w nowotworach glejowych (glejaki), nerwiaku
niedojrzałym, gruczolakach przysadki (wydzielających GH i gruczolakach
nieczynnych), rakach chromochłonnych oraz przyzwojakach (Rys. 8).
Rysunek 8. Budowa peptydu aktywującego cyklazę adenylanową przysadki [19]
Grelina
W ostatnich latach coraz szerszym zainteresowaniem
medycyny nuklearnej cieszy się grelina. Neuropeptyd ten produkowany jest przez
gruczoły właściwe żołądka, skąd wędruje do centralnego układu nerwowego.
Grelina wpływa na ilość spożywanego pokarmu, ruchy perystaltyczne jelit,
wydzielanie kwasów żołądkowych, regulację sekrecji trzustki, otyłość oraz
przyrost wagi ciała. Ten peptyd zbudowany z dwudziestu ośmiu aminokwasów
połączonych liniowo wykazuje swoiste powinowactwo do receptora GHS-R1a,
którego nadekspresję wykryto w komórkach nowotworowych tarczycy, piersi oraz
prostaty [20] (Rys. 9).
Rysunek 9. Budowa greliny [21].
Podsumowanie
Swoiste oddziaływanie biomolekuł naturalnie
występujących w organizmach żywych z określonymi receptorami, bądź epitopami
przeciwciał zlokalizowanymi na powierzchni błon komórkowych, od wielu lat
stanowią obiekt zainteresowania medycyny nuklearnej. Związki naturalnie
występujące w organizmach żywych i wykazujące swoiste powinowactwo do
konkretnych miejsc aktywnych występujących w nadekspresji na komórkach
nowotworowych są bardzo obiecującym narzędziem w celowanej terapii
antynowotworowej. Szeroka gama peptydowych nośników z roku na rok jest coraz
większa i stale rośnie. Wykorzystanie związków naturalnych nie niesie za sobą
efektów cytotoksycznych, a trwale związany radionuklid w szybkim czasie usuwany
jest z organizmu wraz z nośnikiem poprzez nerki. Nowoutworzony radiofarmaceutyk
musi przejść badania kliniczne przed dopuszczeniem do obrotu. Proces ten trwa
latami. Jednakże już dziś dostępne są radiofarmaceutyki oparte na analogach
somatostatyny, które z powodzeniem stosuje się w diagnostyce obrazowej
oraz w celowanej terapii antynowotworowej.
Autor: Karolina Wójciuk
Literatura:
1. Eberle, A.N., Mild, G., Froidevaux, S., 2004. Receptor-Mediated Tumor Targeting with Radiopeptides. Part 1. General Concepts and Methods: Applications to Somatostatin Receptor-Expressing Tumors. J. Recept. Signal Transduct. Res. 24(4), 319-455.
2. Reubi, J.C., Mäcke, H.R., Krenning, E.P., 2005. Candidates for peptide receptor radiotherapy today and in the future. J. Nucl. Med. 46 Suppl 1:67S-75S.
3. Shen, L.P., Rutter, W.J., 1984. Sequence of the human somatostatin I gene. Science 224(4645), 168-71.
4. Gahete, M.D., Cordoba-Chacón, J., Duran-Prado, M., Malagón, M.M., Martinez-Fuentes, A.J., Gracia-Navarro, F., Luque, R.M., Castaño, J.P., 2010. Somatostatin and its receptors from fish to mammals. Ann. N Y Acad. Sci. 1200, 43-52.
5. https://es.m.wikipedia.org/wiki/Archivo:Somatostatin.svg
6. Edkins, J.S., 1906. The chemical mechanism of gastric secretion. J. Physiol. 34(1-2), 133-44.
7. http://commons.wikimedia.org/wiki/File:Little_gastrin.png
8. Gonzalez, N., Moody, T.W., Igarashi, H., Ito, T., Jensen, R.T., 2008. Bombesin-related peptides and their receptors: recent advances in their role in physiology and disease states. Curr. Opin. Endocrinol. Diabetes Obes. 15(1), 58-64.
9. http://www.chemicalbook.com/ChemicalProductProperty_EN_CB2152345.htm
10. Friry, C., Feliciangeli, S., Richard, F., Kitabgi, P., Rovere, C., 2002. Production of recombinant large proneurotensin/neuromedin N-derived peptides and characterization of their binding and biological activity. Biochem. Biophys. Res. Commun. 290(4), 1161-8.
11. http://commons.wikimedia.org/wiki/File:Neurotensin.png
12. Gerard, N.P., Garraway, L.A., Eddy, R.L. Jr., Shows, T.B., Iijima, H., Paquet, J.L., Gerard, C., 1991. Human substance P receptor (NK-1): organization of the gene, chromosome localization, and functional expression of cDNA clones. Biochemistry 30(44), 10640-6.
13. http://biobook.nerinxhs.org/bb/systems/neurology.htm
14. Luger, T.A., Scholzen, T.E., Brzoska, T., Böhm, M., 2003. New insights into the functions of alpha-MSH and related peptides in the immune system. Ann. N. Y. Acad. Sci. 994, 133-40.
15. http://www.chemicalbook.com/ChemicalProductProperty_EN_CB1101371.htm
16. Said, S.I., 2012. Vasoactive intestinal peptide in pulmonary arterial hypertension. Am. J. Respir. Crit. Care. Med. 185(7), 786.
17. http://www.pharmacology2000.com/Autonomics/Adrenergics1/Adrenergic-11.htm
18. Hosoya, M., Kimura, C., Ogi, K., Ohkubo, S., Miyamoto, Y., Kugoh, H., Shimizu, M., Onda, H., Oshimura, M., Arimura, A., Fujino, M., 1992. Structure of the human pituitary adenylate cyclase activating polypeptide (PACAP) gene. Biochim. Biophys. Acta. 1129(2), 199-206.
19. http://www.chemicalbook.com/ChemicalProductProperty_EN_CB7101106.htm
20. Cassoni, P., Papotti, M., Ghè, C., Catapano, F., Sapino, A., Graziani, A., Deghenghi, R., Reissmann, T., Ghigo, E., Muccioli, G., 2001. Identification, Characterization, and Biological Activity of Specific Receptors for Natural (Ghrelin) and Synthetic Growth Hormone Secretagogues and Analogs in Human Breast Carcinomas and Cell Lines. J. Clin. Endocrinol. Metab. 86(4) 1738-1745.
21. http://www.lookchem.com/Ghrelin-rat-/
Tagi: nośnik, wektor, białko receptorowe, przeciwciało, analog, epitopy, radiofarmaceutyk, radionuklid, somatostatyna, gastryna, bombezyna, neurotensyna, substancja P, hormon, melanocyty alfa, wazoaktywny peptyd jelitowy, peptyd
wstecz Podziel się ze znajomymi









Recenzje