- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Właściwości i wybrane metody oznaczania stężenia hemoglobiny cz.I
Cząteczka hemoglobiny składa się z 4 łańcuchów polipeptydowych białka tj.: dwóch łańcuchów α oraz dwóch β. Łańcuchy α i β różnią się między sobą ilością aminokwasów w cząsteczce. Każdy łańcuch peptydowy zawiera około 150 aminokwasów ułożonych w odpowiedniej genetycznie warunkowanej sekwencji. Między pętlami zwiniętego łańcucha aminokwasów- jakby w kieszonce tkwi jedna cząsteczka barwnika- hemu. Jedna cząsteczka globiny przyłącza zawsze 4 cząsteczki hemu [3]. Synteza pierścienia protoporfiryny zachodzi w erytroblastach z glicyny i bursztynylo-CoA. W dalszym etapie, pod wpływem syntezy hemu dochodzi do wbudowania żelaza, w wyniku czego powstaje hem. Hem łączy się następnie z globiną tworząc hemoglobinę [1], [2].
Do określania stężenia hemoglobiny najczęściej stosuje się jednostkę g/L lub g/dL. Wartość ta zależy od płci, wieku, a także warunków środowiskowych. Najpowszechniej stosowaną metodą służącą do określania stężenia hemoglobiny jest metoda cyjanomethemoglobinowa. W przypadku schorzeń związanych z zaburzeniami syntezy hemoglobiny (hemoglobinopatie, talasemie) wykonuje się elektroforezę hemoglobiny lub chromatografię o dużej rozdzielczości. W przypadku pomiaru stężenia hemoglobiny w surowicy lub w moczu, mamy do czynienia z tzw. „wolną hemoglobiną”. Podwyższone stężenie wolnej hemoglobiny w surowicy, a także pojawienie się jej w moczu występuje u osób z nasiloną hemolizą erytrocytów [1].
Każda cząsteczka hemu ma zdolność do nietrwałego, luźnego, przyłączenia jednej cząsteczki tlenu (02). W wyniku tego procesu, tlen umieszcza się i wchodzi w nietrwałe połączenia między żelazem zawartym w grupie hemowej, a jedną z reszt histydyny zawartej w peptydowej pętli. Tak więc, jedna cząsteczka hemoglobiny zawierająca 4 cząsteczki hemu, może jednocześnie przyłączyć cztery cząsteczki tlenu (proces ten zachodzi w płucach) [3]. Hemoglobina połączona z cząsteczką tlenu (Hb-O2) to tzw. oksyhemoglobina (w procesie utlenowania stopień utlenienia żela nie zmienia się). W procesie utleniania żelazo zmienia swój stopień utlenienia z Fe(II) do Fe(III) z jednoczesnym przyłaczeniem cząsteczki wody. W wyniku tej reakcji powstaje tzw. methemoglobina (Met-Hb) [2].
Funkcje fizjologiczne hemoglobiny
W warunkach fizjologicznych hemoglobina uczestniczy w transporcie dwutlenku węgla (CO2). Jej rola w tym procesie polega na odbieraniu całego dyfundującego z tkanek do naczyń włosowatych dwutlenku węgla. W wyniku złożonych reakcji zaraz po wyjściu krwinki z naczynia włosowatego uwalnia się do osocza znaczna większość chwilowo zatrzymanego w krwince CO2, który dalszą wędrówkę do płuc odbywa w osoczu w postaci wodorowęglanów (około 70% transportowanego CO2). Około 10% przenoszonego CO2, wiąże się na okres transportu do płuc z cząsteczką hemoglobiny przez grupy aminowe łańcuchów peptydowych, gdzie w formie związku karbohemoglobiny dociera do naczyń włosowatych pęcherzyków płucnych [3].
Struktury hemoglobiny
W funkcji hemoglobiny bardzo ważną rolę odgrywa budowa białka globiny. Najważniejsze znaczenie ma sekwencja aminokwasów w łańcuchach peptydowych, czyli tzw. struktura I-rzędowa białka. Poza pierwszorzędową strukturą białka , zachowana jest również struktura drugorzędowa, która wyrażona jest odpowiednią konfiguracją przestrzenną, gdyż każdy łańcuch polipeptydowy jest spiralnie zwinięty. Ponadto, oddziaływanie pomiędzy grupami bocznymi aminokwasów zawartych w łańcuchu peptydowym daje dalsze pofałdowanie łańcucha tj. strukturę III-rzędową. Trzeciorzędowość struktury globiny warunkowana jest sekwencją aminokwasów. Co ważne, zmiana tylko jednego aminokwasu w łańcuchu polipeptydowym powoduje widoczne zmiany i to zarówno w przestrzennej budowie cząsteczki, jak też w jej czynności fizjologicznej [3]. W IV-rzędowej strukturze hemoglobiny istotną rolę odgrywa przestrzenne ułożenie wobec siebie równoimiennych łańcuchów polipeptydowych. Połączenie czterech łańcuchów, a więc podjednostek (monomerów) białkowych, w jeden tetramer jest utrzymywane za pośrednictwem kilku typów słabych wiązań chemicznych (wśród nich wyróżnia się mostki wodorowe, mostki solne i wiązania Van der Waalsa). Struktura IV-rzędowa hemoglobiny ma bardzo duże znaczenie, poniewaz to właśnie ona zapewnia występowanie między cząsteczkami hemoglobiny właściwości kooperatywnych. Przyłączenie do hemoglobiny cząsteczki tlenu zwiększa dostępność pozostałych grup hemowych do tlenu, co w rezultacie powoduje, że każda następna cząsteczka łatwiej łączy się z hemoglobiną [3].
Hemoglobina płodowa
Znane są trzy typy prawidłowej hemoglobiny:
- hemoglobina A (Hgb A),
- hemoglobina A2,
- hemoglobina F (Hgb F)
- hemoglobina płodowa [4].
U osób dorosłych w największej ilości występuje hemoglobina Hgb A, stanowiąc >95%, zaś hemoglobina A2 w ilości 1,5% - 3,5%. Z kolei, hemoglobina F u osób dorosłych stanowi mniej niż 1%. W przypadku prawidłowo rozwijającego się płodu i noworodka stosunek hemoglobiny A i F jest odwrócony, gdzie w krwinkach czerwonych płodu znajduje się więcej hemoglobiny F. W celu określenia hemoglobiny płodowej wykonuje się barwienie rozmazu krwi metodą Kleihauer-Betke, gdzie z rozmazu krwi obwodowej matki pod wpływem kwaśnego buforu (pH 3.3), zostają usunięte wszystkie formy hemoglobin (z wyjątkiem HbF). Krwinki czerwone, zawierające hemoglobinę płodową zabarwiają się na kolor różowy [4]. Około 5 - 6 tygodnia życia płodowego, hemoglobina zbudowana jest z białek „e”-epsilon. Następnie, pojawia się hemoglobina HbF,która już zbudowana jest z 2 łańcuchów a i 2 łańcuchów g. Hemoglobina HbF stanowi ok. 90 - 95 % hemoglobiny u płodu w 4 - 5 miesiącu ciąży. Wraz z upływem każdego tygodnia jej zawartość obniża się o 3% do 4 % tygodniowo do 34 - 36 tygodnia ciąży. Proces ten powoduje, że wystąpienie przedwczesnego porodu sprzyja występowaniu niedokrwistości u dziecka.
Oznaczanie stężenia hemoglobiny (metoda Drabkina)
Hemoglobina i jej pochodne (z wyłączeniem sulfhemoglobiny) pod wpływem żelazicyjanku potasu ulegają utlenieniu do methemoglobiny. Maethemoglobina w reakcji z cyjankiem potasu daje trwały związek, zwany cyjanmethemoglobiną. Związek ten charakteryzuje się czerwono-brunatną barwą, a jego maksimum absorbancji mierzy się przy długości fali równej λ= 540 nm [5].
Wykonanie:
Stężenie hemoglobiny we krwi:
CHb we krwi = Abadana / Awzorca x Cwzorca (g/dl)
Stężenie hemoglobiny w surowicy:
CHb w surowicy = Abadana / Awzorca x Cwzorca (mg/dl) [5].
Hemoglobina (Hb lub Hgb) jest kulistym białkeim występującym głównie w erytrocytach, gdzie przenosi tlen z płuc do tkanek uwalniając tlen, a zabierając w powrotnej drodze dwutlenek węgla (z tkanek do płuc). Poza wiązaniem i transportem tlenu hemoglobina wiąże także CO2, tlenek węgla (CO) oraz tlenek azotu (NO).
Kit do kolorymetrycznego oznaczania hemoglobiny (Cayman Chemical) zapewnia szybki i niezawodny sposób określania stężenia całkowitej hemoglobiny w różnych próbkach biologicznych, w tym we krwi, homogenatach tkankowych oraz lizatach komórkowych. W przeciwieństwie do powszechnie przyjętego sposobu oznaczania hemoglobiny, wykorzystującego jako reagent cyjanek potasu, kit ten wykorzystuje zoptymalizowane odczynniki, które są nietoksyczne i dają dokładne wyniki pomiaru całkowitego stężenia hemoglobiny w zakresie absorbancji między 560 a 590 nm. Pojawiające się w wyniku reakcji intensywne zabarwienie jest wprost proporcjonalne do stężenia całkowitej hemoglobiny w próbce [6].
Odczynniki:
- 10x stężony bufor hemoglobinowy: fiolka zawiera 10 ml stężonego buforu do próbek (1 M fosforan potasu pH 7,4, zawierający 10 mM EDTA). Zawartość fiolki należy rozcieńczyć 90 ml wody do HPLC. Rozcieńczona próbka buforu (100 mM fosforan potasu, pH 7,4, zawierający 1 mM EDTA) jest używana do rozcieńczania próbek. Przy przechowywaniu w temperaturze 4 °C, roztwór jest trwały przez okres sześciu miesięcy.
- 4x stężony detektor hemoglobiny : każda fiolka zawiera 10 ml stężonego detektora hemoglobiny. Rozcieńczyć zawartość fiolki 30 ml wody do HPLC. Jedna fiolka wystarcza na oznaczenie jednej 96-dołkowej płytki. Przy przechowywaniu w temperaturze 4 °C, rozcieńczony detektor hemoglobiny jest trwały przez co najmniej jeden miesiąc.
- standard hemoglobiny: każda fiolka zawiera 1 ml 500 µM hemu. Odczynnik jest gotowy do przygotowania krzywej wzorcowej. Przy przechowywaniu w temperaturze 4 °C jest trwały przez okres sześciu miesięcy.
Przygotowanie próbek
Osocze: normalne stężenie hemoglobiny w osoczu ludzkim wynosi 0,03 g/dl.
- Pobrać krew stosując antykoagulant (heparyna lub cytrynian)
- Zwirować krew przy 700 – 1 000 x g przez 10 minut w temperaturze 4°C. Po wirowaniu pipetą zebrać górną żótą warstwę plazmy, uważając by nie naruszyć białej warstwy kożuszka. Przechowywać na lodzie lub w -80°C do momentu oznaczenia. Próbka osocza jest stabilna przez okres 1 miesiąca, jednakże należy unkać powtarzania cykli rozmrażania i zamrażania próbek. Przed oznaczeniem plazma nie musi być rozcieńczona.
Surowica:
- Pobrać krew do probówek bez koagulantu, po czym pozwolić krwi zakrzepnąć przez 30 minut w temperaturze 25°C.
- Zwirować przy 2000 x g przez 15 minut w temp. 4°C. Pipetą zebrać górną warstwę surowicy bez naruszania białej warstwy kożuszka. Surowicę przechowywać na lodzie, jeśli oznaczenie nie jest wykonywane tego samego dnia próbkę należy zamrozić w temp. -80°C (próbka będzie trwała przez 1 miesiąc). Przez oznaczeniem surowica nie musi być rozcieńczana.
Pełna krew: normalne stężenie hemoglobiny w ludzkiej krwi waha się w granicach 12 – 18 g/dl4.
- Pobrać próbkę krwi na antykoagulant
- Próbkę krwi przechowywać w 4°C (zamrażanie krwi często powoduje lizę krwinek czerwonych).
- Pełna krew przed oznaczeniem musi być rozcieńczona (zwykle wymagane jest rozcieńczenie próbek ³ 1:10).
Krwinki czerwone:
- Krew pobrać na antykoagulant (np. heparyna)
- Odwirować próbkę przy 700 – 1000 x g przez 10 minut w temp. 4°C. Zebrac górną żółtą warstwę plazmy, a następnie białą warstwę. Na samym dole próbki znajdują się czerwone krwinki krwi, które należy zebrać i przechowywać na lodzie, aż do momentu wykonania oznaczenia.
- Doprowadzić do lizy czerwonych krwinek poprzez rozcieńczenie próbki wodą w sosunku 1:1, po czym próbkę odwirować.
- Jeżeli oznaczenie nie jest wykonywane tego samego dnia, próbkę należy zamrozić w -80°C (będzie ona stabilna przez 1 miesiąc).
- Końcowe rozcieńczenie próbki przed oznaczeniem powinno być ³ 1:10 [6].
Homogenat tkanek
- Przepłukać tkankę w roztworze soli fizjologicznej (PBS) o pH=7,4 zawierającym 0,16 mg/ml heparyny, w celu usunięcia czerwonych krwinek oraz skrzepów.
- Tkankę homogenizować w bufrze PBS (5-10 ml) pH=7.4, zawierającym 0,16mg/ml heparyny na gram tkanki.
- Próbkę zwirować przy 10 000 xg przez 15 minut w 4°C.
- Po wirowaniu usunąć supernatant, a próbkę przechowywać na lodzie. Jeżeli oznczenie nie jest wykonywane tego samego dnia, należy ją zamrozić w -80°C (próbka będzie trwała przez co najmniej 1 miesiąc) [6].
Oznaczenie wykonuje się na 96-dołkowej płytce, przy czym nie istnieje określony wzór nakładania na płytkę standardu hemoglobiny i próbek. Ważne jest by każda próbka mierzona była w dwóch powtórzeniach (http://www.caymaneurope.com/pdfs/700540.pdf)
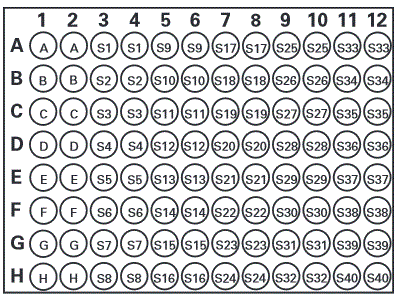
Zdjęcie: płytka 96-dołkowa (studzienki), http://www.caymaneurope.com/pdfs/700540.pdf
A-H – standard
S1 – S40 – przykładowe studzienki
Informacje ogólne dotyczące kitu (http://www.caymaneurope.com/pdfs/700540.pdf)
- Końcowa objętość próbki wynosi 200 ul (we wszystkich studzienkach).
- Przed przystąpieniem do oznaczenia wszystkie odczynniki należy doprowadzić do temperatury pokojowej.
- Zalecane jest wykonywanie oznaczenia próbek w co najmniej dwóch powtórzeniach.
- Oznaczenie należy wykonywać w temperaturze pokojowej.
- Wartość absorbancji mierzona jest w zakresie 560-590 nm [6].
Przygotowanie standardu
Standard należy przygotować zgodnie z tabelą zamieszczoną w instrukcji producenta. Przygotować 8 czystych, szklanych probówek opisanych kolejno od A-H, po czym odmierzyć do nich (zgodnie z instrukcją) standard hemoglobiny oraz detector hemoglobiny (zdjęcie poniżej):
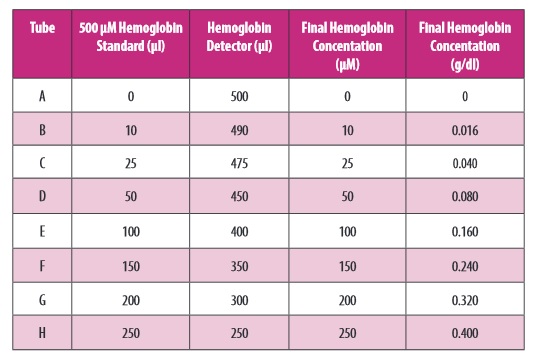
Zdjęcie: przygotowanie standardu, http://www.caymaneurope.com/pdfs/700540.pdf
Wykonanie oznaczenia:
- Do studzienek przeznaczonych na standard (opisanych A-H) odpipetować po 200 µl standardu hemoglobiny
- Do studzienek przeznaczonych na próbki odpipetować po 20 µl danej próbki (w dwóch powórzeniach)
- Do każdej studzienki z próbką należy odpipetować po 180 µl detectora hemoglobiny (nie dodawać do studzienek ze standardem)Płytkę nakryć folią i inkubować w temp. pokojowej przez 15 minut.
- Po upływie czasu inkubacji zmierzyć absorbancję w zakresie 560-590 nm. Co ważne, przed pomiarem absorbancji należy upewnić się, że w studzienkach nie ma pęcherzyków powietrza, które utrudniają pomiary [6].
Na podstawie uzyskanych wyników należy oznaczyć stężenie hemoglobiny w badanych próbkach korzystając z przygotowanej wcześniej krzywej wzorcowej, a dane podstawiając do odpowiedniego wzoru (podany w instrukcji producenta) [6].
Otrzymywanie oksyhemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Materiał do badań: roztwór krwi w wodzie tj. 0,5 ml krwi w 10 ml H2O
Wykonanie:
Roztwór krwi w wodzie należy wytrząsać w probówce- w tym czasie hemoglobina nasyca się tlenem z powietrza i zmienia się w Hb-O2. Kolor roztworu zmienia się w jasnoczerwony. Roztwór oglądany w spektroskopie wykazuje 2 smugi : w żółtej i zielonej części widma, tj. przy 578 nm i 540 nm. W przypadku, gdy badany roztwór daje szerokie smugi absorpcyjne należy go odpowiednio rozcieńczyć (ma być widoczne wyraźne charakterystyczne widmo). Rozcieńczenie należy prowadzić uważnie, gdyż zbyt duże powoduje, że smugi absorpcyjne zanikają [2].
Otrzymywanie hemoglobiny (wg Kłyszejko-Stefanowicz L., 2003)
Wykonanie:
Do otrzymanego roztworu oksohemoglobiny należy dodac kilka kryształków środka redukującego (np. dwutionian sodu). Próbkę wymieszać (następuje zmiana barwy roztworu na czerwono-fioletową). W trakcie obserwacji w spektroskopie występuje tylko jedna smuga przy długości fali równej λ=565 nm. Świadczy to o przejściu oksyhemoglobiny w hemoglobinę. W przypadku, gdy do próbki nie dodano nadmiaru dwutionianu sodu, energiczne wytrząsanie próbki spowoduje ponowne przejście hemoglobiny w oksyhemoglobinę (pojawią się charakterystyczne dwie smugi w trakcie oglądania w spektroskopie) [2].
Autor: Lidia Koperwas
Literatura:
[1]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska, s. 181-185.
[2]. Kłyszejko-Stefanowicz L., 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.582-587.
[3]. http://www.analiza-medyczna.pl/krew.html
[4]. http://www.labtestsonline.pl/Glossary/Glossary_Kleihauer_BetkeFetalHemoglobinStain.html
[5].http://biochemia.sum.edu.pl/0-CWICZENIA%20CALOSC/Cwiczenia%20-%20BIOCHEMIA%20MEDYCZNA/LAB7_Bm_BT_hemoglobina.pdf
[6]. Hemoglobin Colorimetric Assay Kit ,Cayman Chemical Item Number 700540, https://www.caymanchem.com/app/template/Product.vm/catalog/700540, http://www.caymaneurope.com/pdfs/700540.pdf
Tagi: hemoglobina, hem, oksyhemoglobina, globina, hemoglobina płodowa, Hgb F, metoda Drabkina, stężenie całkowitej hemoglobiny, kolorymetryczne oznaczanie hemoglobiny
wstecz Podziel się ze znajomymi









Recenzje