- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Glukoza - niezbędne źródło energii dla organizmu
Glukoza zaliczana jest do najważniejszych węglowodanów, ponieważ większość węglowodanów, które zawarte są w pokarmach wchłania się do krwiobiegu właśnie w postaci glukozy. Ponadto węglowodany przekształcane są w glukozę w wątrobie, a w organizmie z glukozy mogą powstać wszystkie inne cukry. Glukoza stanowi istotne źródło energii w tkankach ssaków , a także odgrywa bardzo ważną rolę w prawidłowym rozwoju płodu. Cukier ten przekształcany jest w inne cukry odgrywające swoiste rolę np. w rybozę, która występuje w kwasach nukleinowych czy galaktozę obecną w laktozie mleka [1].
Glukoza jest niezbędna do prawidłowego funkcjonowania metabolizmu komórkowego. Szczególnie wrażliwe na brak glukozy są komórki nerwowe. W organizmie związek ten wykorzystywany jest głównie jako źródło energii. Ponadto glukoza reguluje przemianę tłuszczową, zmniejsza stopień zatrucia jadami, a także przyspiesza gojenie się ran [7].
Oznaczanie glikemii (poziomu cukru we krwi) w monitorowaniu cukrzycy
Oznaczanie glikemii przeprowadzane w celu monitorowania leczenia i oceny wyrównania metabolicznego cukrzycy wykonywane jest w pełnej krwi włośniczkowej. Krew włośniczkowa pobierana jest zwykle z opuszki palca, a u noworodków i dzieci z pięty. Niestety przydatność tego typu materiału jest mocno ograniczona, co w głównej mierze wynika z faktu domieszki płynu tkankowego, słabą standaryzacją stosowanej do pobrania procedury, a także ilości możliwych do wykonania badań. Największe znaczenie w badaniach ma krew żylna, z kolei krew włośniczkowa pobierana jest wtedy, gdy pobranie krwi żylnej nie jest możliwe lub utrudnione [2], [3].
Glukoza bardzo szybko transportowana jest przez błonę komórkową do wnętrza erytrocytów. Transport odbywa się przez transportery glukozy określane jako GLUT. Transporter glukozy 1 (GLUT1) uważany jest za najlepiej poznaną i najbardziej rozpowszechnioną izoformę rodziny białek GLUT. W stanach fizjologicznych wysoki poziom ekspresji GLUT1 obserwuje się: w erytrocytach (3–5% wszystkich białek błonowych), nabłonku endotelialnym, nabłonku epitelialnym bariery krew–mózg, oku, łożysku oraz gruczole mlekowym ssaków [3],[4]. Przeprowadzone badania sugerują możliwość zastosowania GLUT1 jako prognostycznego wskaźnika złośliwości oraz stopnia zaawansowania nowotworów. Co więcej wskaźnik ten umożliwiłby wyodrębnienie pacjentów wymagających agresywniejszej terapii [4].
Stężenie glukozy w erytrocytach jest niższe niż w osoczu, co wynika z faktu jej przemiany do glukozo-6-fosforanu. Pomiar stężenia glukozy glukometrami daje zazwyczaj niższe wartości glikemii niż stosowane analizatory laboratoryjne, które mierzą ten metabolit w osoczu. Oznaczenia glukozy wykonywane w monitorowaniu cukrzycy przeprowadzane są w różnych porach dnia (zależnych od aktywności chorego i przyjmowanych posiłków), kiedy to oczekuje się skrajnych wartości glikemii w ciągu doby. Dobowy profil glikemii obejmuje pomiary glukozy wykonywane: rano na czczo, przed każdym głównym posiłkiem, 120 minut po każdym głównym posiłku, przed snem, o północy oraz o godzinie 3:30 w nocy [2].
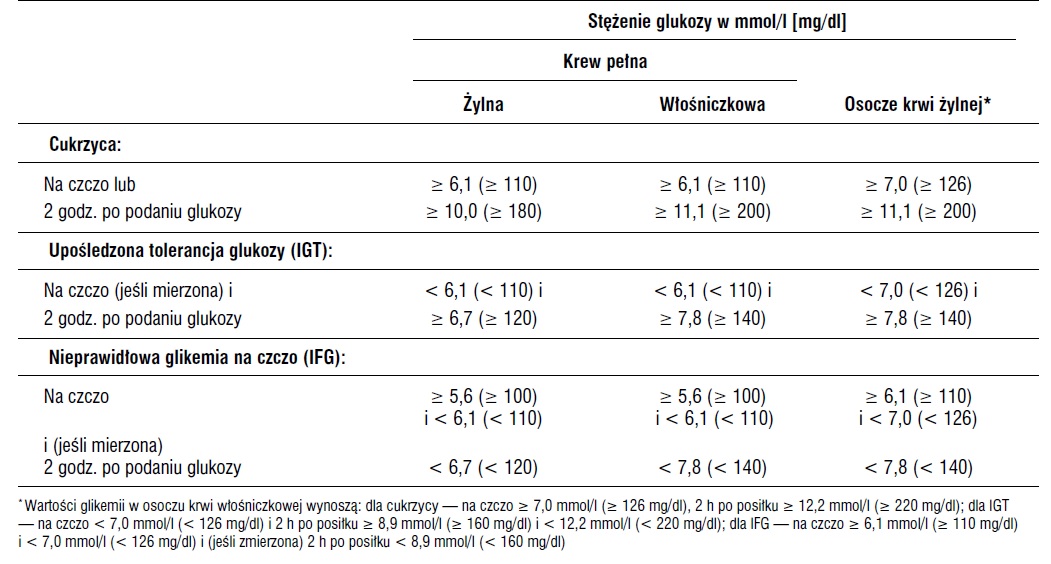
Zdjęcie: Wartości diagnostyczne cukrzycy i innych stanów hiperglikemii, wg Górczyńska-Kosiorz S., Grzeszczak W., Mazur B., 2005 [6].
Zasady pobierania i przechowywania próbek krwi do badań poziomu glukozy
Materiałem do oznaczania glukozy może być: pełna krew żylna, surowica na skrzep lub krew włośniczkowa. Krew włośniczkowa natychmiast po pobraniu musi być hemolizowana i odbiałczona bądź należy od razu po pobraniu wykonać pomiar. Jeśli oznaczenia wykonuje się w pełnej krwi, próbkę należy przechowywać w temperaturze 0–4°C albo niezwłocznie odwirować lub wykonać pomiar. We krwi włośniczkowej arterializowanej po posiłku stężenie glukozy jest do 20% większe niż we krwi żylnej. Pomiar wykonywany w surowicy i osoczu jest o 10% - 15% wyższy niż uzyskany z pełnej krwi, co ma związek z brakiem obecności w próbce krwinek. Glukoza nie powinna być oznaczana w surowicy,jeśli z próbki dobrze nie usunięto erytrocytów,ponieważ z powodu zachodzącej glikolizy może dojść do nieprzewidywalnego zaniżenia rzeczywistego stężenia glukozy [6].
Na jakość wykonywanych oznaczeń glukozy w bardzo dużej mierze decyduje prawidłowe postępowanie z materiałem przeznaczonym do badań w fazie przed-analitycznej. Należy mieć na uwadze, że w pobranej próbce krwi glukoza jest metabolizowana przez krwinki również in vitro, w związku z czym krwinki muszą zostać oddzielone od osocza do 60 minut od pobrania materiału. Tak więc wymóg ten określa najdłuższy czas w jakim pobrana próbka krwi musi być dostarczona do laboratorium, by nadawała się do badań. W temperaturze pokojowej zachodzący w krwinkach proces glikolizy powoduje zmniejszanie stężenia glukozy o 5-7% w ciągu godziny a we krwi, która zawiera dużą liczbę leukocytów spadek ten jest większy. Przechowywanie pełnej krwi w lodówce w temp. 4°C powoduje spadek stężenia glukozy o około 20% w ciągu 24 godzin. By temu przeciwdziałać zaleca się dodawanie do pobieranej krwi substancji spowalniających glikolizę, np. fluorku sodu czy jodooctanu sodu. Związki te zazwyczaj są stosowane razem z antykoagulantami, takimi jak szczawian lub EDTA [5].
Metabolizm glukozy w prawidłowych komórkach
W komórkach prawidłowych w procesie tzw. glikolizy, glukoza metabolizowana jest do dwóch cząsteczek pirogronianu. W wyniku tej reakcji dochodzi do wytworzenia dwóch cząsteczek ATP. Powstały pirogronian w mitochondriach jest następnie utleniany do acetylo-CoA , co zachodzi z udziałem kompleksu dehydrogenazy pirogronianowej. W kolejnym etapie acetylo-CoA wchodzi w cykl Krebsa, w którym ulega utlenieniu do dwutlenku węgla (CO2), a zmagazynowana energia (w postaci koenzymów: NADH i FADH2 ) podlega przemianie w cząsteczki ATP podczas transportu elektronów poprzez układy oksydoredukcyjne łańcucha oddechowego. W wyniku całkowitego utlenienia cząsteczki glukozy powstaje 30 cząsteczek ATP [4].
Glukoza stanowi podstawowe źródło energii dla dla ośrodkowego układu nerwowego. Wszelkie zaburzenia w dostarczaniu glukozy do mózgu wywołują: ostre, podostre i przewlekłe zaburzenia funkcji mózgu, które określane są mianem neuroglikopenii. Przewlekłe i nawracające stany hipoglikemiczne prowadzą do powstawania ogniskowych uszkodzeń mózgu, które następnie są przyczyną rozwoju zespołów psychoorganicznych (np. zmian osobowości, ubytków pamięci, demencji). Co więcej cukrzyca stanowi jeden z czynników zwiększonego ryzyka zachorowania na chorobę Alzheimera [2].
Metody enzymatyczne oznaczania glikemii
Oznaczenie glukozy we krwi (osoczu) można wykonać kilkoma różnymi metodami. Stosowane są 2 metody enzymatyczne, gdzie jedna bazuje na wykorzystaniu do reakcji oksydazy glukozowej, a druga układ heksokinaza/dehydrogenaza glukozo-6-fosforanu; metoda toluidynowa (swoista dla aldoloz) czy metoda Samogyi-Nelsona oraz jej modyfikacje oparte na redukcji miedzi.
Pomiar przebiegu zachodzących reakcji odbywa się przy użyciu technik spektrofotometrycznych i technik amperometrycznych. Metodą referencyjną (odniesienia) dla oznaczenia glukozy jest spektrometria masowa z rozcieńczeniem izotopu (ID-MS, isotope dilution mass spectometry).
W laboratoriach najczęściej stosowana jest metoda oksydazowa z wykorzystaniem różnych technik pomiaru. Za drugorzędną enzymatyczną metodę oznaczania glukozy uznawana jest metoda heksokinazowa, która charakteryzuje się stosunkowo lepszą czułością oraz swoistością w porównaniu do metody oksydazowej. Metoda heksokinazowa wykazuje również mniejszą podatność na czynniki interferujące [6].
Metoda Nelsona – wykorzystanie do oznaczania stężenia glukozy we krwi (wg Krajewski T., 1959).
Zasada metody: metoda polega na odbiałczeniu krwi za pomocą koloidalnej zawiesiny wodorotlenku cynku. Otrzymany przesącz gotuje się z roztworem zawierającym Cu(II) i Cu(I), w wyniku czego w próbce powstaje ceglasty osad Cu2O. Tlenek miedzi (I) rozpuszcza się w odczynniku arsenomolibdenowym, w wyniku czego w próbce pojawia się niebieskie zabarwienie [7], [8].
Przygotowanie odczynników:
1) Odczynnik miedziawy I: w 600 ml wrzącej wody rozpuścić 200 g bezwodnego Na2SO4 (lub 356 g Na2SO4). Następnie, w 100 ml wody rozpuścić 25 g soli Seignetta (winian sodowo-potasowy). Obydwa roztwory zmieszać w 1-litrowej kolbie miarowej, po czym dodać 20 g NaHCO3 oraz 25 g bezwodnego Na2CO3. Całość dokładnie rozpuścić i uzupełnić wodą do kreski. Otrzymany roztwór należy przesączyć w przypadku, gdy pojawi się zmętnienie. Tak przygotowany odczynnik przechowywać w temperaturze 37°C (gdy wytrącą się kryształy należy je rozpuścić przed użyciem przez lekkie ogrzanie roztworu w łaźni wodnej) [7], [8].
2) Odczynnik miedziowy II: 15% roztwór CuSO4∙5 H2O + 1-2 krople stężonego roztworu H2SO4.
3) Mieszanina odczynnika miedziowego I i II: bezpośrednio przed użyciem sporządzić roztwór z obydwu odczynników zmieszanych w stosunku 25:1.
Wykonanie:
W stosunku 5:1 należy zmieszać odpowiednią ilość mieszaniny roztworów: 0,45% (rozcieńczyć z roztworu 45%) ZnSO4 i 0,1 M NaOH (0,4%). Do 2,9 ml mieszaniny odczynników dodać 0,1 ml krwi pobranej z opuszka palca. Pipetę oczyścić z krwi z zewnątrz, wydmuchać krew do mieszaniny i następnie przepłukać pipetę tą samą mieszaniną. Otrzymaną w ten sposób próbkę umieścić we wrzącej łaźni wodnej (3-5 minutowa inkubacja). Po upływie czasu inkubacji próbkę należy ostudzić i przesączyć przez mały sączek.
Następnie do 1 ml przesączu dodać 1 ml mieszaniny odczynników miedziowych (odczynnik miedziowy I i II), próbkę gotować we wrzącej łaźni wodnej przez 20 minut. Ostudzić, po czym wprowadzić 1 ml odczynnika arseno-molibdenowego (tj.: 25 g molibdenianu(VI)amonu rozpuścić w 450 ml wody, dodać 31 ml stężonego roztworu H2SO4. W osobnym naczyniu rozpuścić 3 g arsenianu(V)sodowego w 25 ml wody. Obydwa roztwory zmieszać i inkubować w temp. 37°C przez 24-48h lub ogrzać do temp. 55°C i trzymać w tej temperaturze przez 25 minut). Próbkę wytrząsać do momentu przestania wydzielania pęcherzyków gazu (CO2), a cały tlenek miedzi(I) (miedziawy) rozpuści się. Do próbki dodać 7 ml wody, zmieszać i wykonać oznaczenie kolorymetryczny przy długości fali równej λ= 660 nm (wobec próbki kontrolnej).
W analogiczny sposób należy wykonać oznaczenie z roztworem wzorcowym, gdzie zamiast 0,1 ml krwi pobiera się 0,1 ml roztworu wzorcowego o odpowiednim stężeniu mieszczącym się w zakresie od 10 do 200 mg/100 ml – przyrządzonego przez rozcieńczenie roztworu wzorcowego glukozy.
Wykonanie obliczeń: zachodząca w trakcie oznaczenia reakcja barwna stosuje się do prawa Lamberta-Beera. Stężenie glukozy można obliczyć ze wzoru, z krzywej kalibracyjnej [7],[8].
Oznaczanie glukozy metodą kolorymetryczną z oksydazą glukozy w wykorzystaniem zestawu diagnostycznego (Lquick Cor-GLUCOSE ).
Do oznaczenia wykorzystuje się roztwór wzorcowy glukozy o stężeniu 100 mg/dl (5,5 mmol/l). Materiałem badanym jest próbka surowicy krwi ludzkiej [9].
Wykonanie:
a) Oznaczenie próby zerowej: odczynnik do oznaczeń pozostawić do osiągnięcia temperatury pokojowej. Następnie do kuwety polistyrenowej (d=10 mm) należy pobrać 800 ml odczynnika, po czym dokonać pomiaru absorbancji przy długości fali λ=500 nm.
b) Oznaczenie próby wzorcowej: do probówki typu eppendorf dodać 1 ml odczynnika do oznaczeń. Próbkę pozostawić do osiągnięcia temperatury pokojowej. Następnie dodać 10 μl roztworu wzorcowego, całośc dokładnie wymieszać i pozostawić na 10-minutową inkubację. 800 ml roztworu przenieść do kuwety pomiarowej. Zmierzyć absorbancję próbki przy długości fali równej λ= 500 nm (względem próby zerowej będącej próbą odniesienia). Pomiar powtórzyć trzykrotnie.
c) Oznaczenie próbki badanej: do probówki typu eppendorf dodać 1 ml odczynnika do oznaczeń, pozostawić do osiągnięcia temperatury pokojowej. Po ustaleniu temperatury dodać 10 μl roztworu badanego, próbkę wymieszać i pozostawić na 10 min inkubacji. Przenieść 800 ml roztworu do kuwety pomiarowej, po czym zmierzyć absorbancję przy długości fali λ=500 nm (względem próby zerowej jako próby odniesienia). Pomiar powtórzyć trzykrotnie [9].
Na podstawie otrzymanych wyników należy obliczyć stężenie glukozy w badanej próbie. W tym celu skorzystać ze wzoru:
Stężenie glukozy= A (PB) / A(PW) x stężenie wzorca
Gdzie:
A(PB)- wartość absorbancji dla próby badanej
A(PW)- wartość absorbancji dla próby wzorcowej [9].
Metoda o-toluidynowa do oznaczania stężenia glukozy (wg Krawczyński J., Osiński T., 1967)
W wyniku ogrzewania z o-toluidyna w środowisku bezwodnym (lodowaty kwas octowy) glukoza daje barwny produkt kondensacji. Poza glukozą reakcji tej ulega również galaktoza. Słabej reakcji w powyższych warunkach ulega z kolei fruktoza.
Wykonanie:
a) Wykreślenie krzywej kalibracyjnej: do probówek odmierzyć następujące ilości roztworu wzorcowego glukozy (roztwór wzorcowy glukozy o stężeniu 100 mg/100 ml sporządzony w 0,2% roztworze kwasu benzoesowego): 0,1; 0,2; 0,3; 0,4 oraz 0,6 ml.
Próbki uzupełnić kwasem trichlorooctowym do objętości 1,2 ml. Z każdej probówki pobrać po 0,5 ml do wywołania barwy. Poszczególne roztwory odpowiadają następującym stężeniom: 50, 100, 150, 200 oraz 300 mg/100 ml [7], [10].
b) Oznaczenie: do probówki wirówkowej dodać 1 ml 5% roztworu CCl3COOH oraz 0,2 ml krwi (mikropipetę z krwi przepłukać roztworem z probówki). Próbkę wymieszać i odwirować (po kilku minutach). Do 0,5 ml otrzymanego po wirowaniu supernatantu należy dodać 4,5 ml odczynnika o-toluidynowego (tj.: 1,5 g tiomocznika rozpuścić w 940 ml lodowatego kwasu octowego i dodać 60 ml o-toluidyny). Próbkę wstawić do wrzącej łaźni wodnej na dokładnie 8 minut!. Po inkubacji ochłodzić pod bieżącą wodą, a następnie zmierzyć wartość absorbancji przy długości fali równej λ=630 nm (wobec próby kontrolnej, gdzie zamiast 0,5 ml supernatantu bierze się 0,5 ml roztworu CCl3COOH). Wynik należy odczytać z przygotowanej krzywej kalibracyjnej [7], [10].
Autor: Lidia Koperwas
Literatura:
[1]. Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W.,1995. BIOCHEMIA HARPERA, Wydanie III, Redaktor naukowy tłumaczenia Franciszek Kokot. Wydawnictwo Lekarskie PZWL, s.161-162
[2]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska, s.243-244; 251-252
[3]. http://www.invicta.pl/upload/PZPOZ/ODCINEK%2010%20INVICTA.pdf
[4]. Jóźwiak P., Lipińska A., 2012. Rola transportera glukozy 1 (GLUT1) w diagnostyce i terapii nowotworów. Postepy Hig Med Dosw (online), 2012; 66: 165-174
[5]. http://diabetologiaonline.pl/lekarz_diabeto_adoz,info,76,0.html
[6]. Górczyńska-Kosiorz S., Grzeszczak W., Mazur B., 2005. The classification of diabetes including genetic predisposition and laboratory tests useful to diagnose disorders of carbohydrate metabolism. Praca poglądowa. Diabetologia Doświadczalna i Kliniczna rok 2005, tom 5, nr 4
[7]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.603-605.
[8]. Krajewski T., 1959. Oznaczanie poziomu cukru we krwi uproszczoną metodą Nelsona. Pol.Tyg.Lek., 14: 922-924.
[9]. http://www.pchba.amu.edu.pl/cw%20CBA/cw2.pdf
[10]. Krawczyński J., Osiński T., 1976. Laboratoryjne metody diagnostyczne. PZWL., Warszawa, s.943.
Tagi: glukoza, hiperglikemia, cukrzyca, metoda Nelsona, metabolizm glukozy, metoda kolorymetryczna, metoda o-toluidynowa, krzywa kalibracyjna, prawo Lamberta-Beera
wstecz Podziel się ze znajomymi









Recenzje