- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Katalityczny reforming glicerolu
WYKORZYSTANIE CZYSTEJ GLICERYNY W PRZEMYŚLE
Glicerol jest przykładem niezwykle atrakcyjnego chemicznie, a zarazem określanego mianem "przyjaznego dla środowiska" produktu ubocznego podczas otrzymywania biodiesla. Największe zastosowanie glicerol znajduje w przemyśle farmaceutycznym i kosmetycznym. Nie ma on działania toksycznego, dlatego jest stosowany w przemyśle spożywczym jako słodzik i środek utrzymujący wilgoć. Popularnie wykorzystywany jako składnik niskowrzących płynów hamulcowych i chłodniczych. Stosowany również do wypełniania manometrów pracujących w ekstremalnych warunkach (CICHY I WSPÓŁAUT., 2009).
Glicerol może też ulegać reakcjom chemicznym takim jak: utlenianie (wzrost stopnia utlenienia pierwiastka), chlorowodorowanie (reakcja addycji halogenowodorów), dehydratacja (usunięcie cząsteczek wody z uwodnionego związku chemicznego) itd. Jedną z możliwych przemian jest otrzymanie z niej epichlorohydryny. Jest to główny składnik w produkcji żywic epoksydowych czy farb podkładowych. Interesujące jest, że do niedawna to epichlorohydryna uważana była za surowiec podczas produkcji glicerolu. Podobnie było z akroleiną, którą można otrzymać w procesie dehydratacji gliceryny lub za pomocą procesu konwersji. Coraz większe zainteresowanie budzi wykorzystanie glicerolu do produkcji zmodyfikowanych komponentów. Mogą one m.in. zostać wykorzystane jako dodatki do paliw lub rozpuszczalników (MELCER I WSPÓŁAUT., 2011).
REFORMING GLICEROLU Z PARĄ WODNĄ
Reforming glicerolu z parą wodną to proces produkcji wodoru i gazów syntezowych. Prowadzony jest w temperaturze od 700 do 900 [ ], w obecności katalizatora metalicznego. Konwersja glicerolu w gaz syntezowy z uwzględnieniem następczej reakcji konwersji tlenku węgla z parą wodną (WSGR – water gas shift reaction) jest obecnie szeroko omawianą w literaturze metodą pozwalająca na zagospodarowanie odpadu jakim jest glicerol (CICHY I WSPÓŁAUT., 2009). Gaz syntezowy z glicerolu może być otrzymywany przez: reforming parowy, reforming w fazie wodnej (APR), czy zgazowanie w wodzie w warunkach pod- i nadkrytycznych (RYCZKOWSKI I WSPÓŁAUT., 2012).
Głównym produktem tych procesów jest wodór. W reakcji reformingu parowego z jednej cząsteczki glicerolu możemy otrzymać maksymalnie, aż siedem cząsteczek wodoru, podczas gdy w konwersji bioetanolu powstaje sześć, a metanolu tylko trzy cząsteczki wodoru. Proces reformingu glicerolu można zapisać jako:
Reforming parowy glicerolu zachodzi w wysokich temperaturach (od 700 do 900 st. C). Ze względu na silnie endotermiczny efekt reakcji (posiada ujemny bilans wymiany ciepła z otoczeniem), najlepsze wyniki zostały osiągnięte w temperaturach 800-900 st. C.
W chwili obecnej prowadzone są prace badawcze w celu otrzymania katalizatora, który pozwoliłby na znaczne obniżenie temperatury prowadzenia procesu, a dodatkowo charakteryzowałby się wysoką stabilnością aktywności w czasie pracy. Prócz tego powinien on zapewnić możliwie wysoki stopień konwersji (tj. przereagowania) glicerolu i selektywności do wodoru (RYCZKOWSKI I WSPÓŁAUT., 2012).
REFORMING GLICEROLU WSPOMAGANY SORPCJĄ
W celu poprawy efektywności prowadzenia reformingu parowego metanu (reakcja odwracalna) zaproponowano realizację procesu z równoczesnym usuwaniem jednego z produktów reakcji tj. ditlenku węgla (HUFTON I WSPÓŁAUT., 1999).
W ostatnim czasie zaproponowano wykorzystanie tego rozwiązania do reformingu parowego glicerolu (FERMOSO I WSPÓŁAUT., 2012). Niezależnie od rodzaju surowca sposób realizacji procesu jest taki sam dla wytwarzania gazu bogatego w wodór z biomasy z jednoczesnym usuwaniem CO2 na sorbencie czyli w układzie wspomaganej sorpcją reakcji (SER – sorption-enhanced reaction) (KOTOWSKI I WSPÓŁAUT., 2005).
Chemisorpcja powstającego CO2 powoduje przesunięcie równowagi chemicznej w kierunku powstania wodoru zgodnie z równaniami 4,5,6.
wstecz Podziel się ze znajomymi









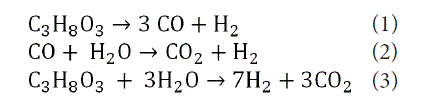
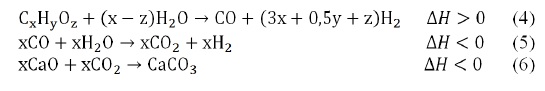
Recenzje