- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Izolacja oraz analiza wybranych parametrów płytek krwi cz. 1
Etapy frakcjonowania krwi:
1) W trakcie pobierania i po pobraniu krwi, próbkę należy delikatnie wymieszać przez powolne odwracanie.
2) Pobrana krew należy przenieść do probówki z tworzywa sztucznego (odpowiedniej do wirowania) za pomocą pipety z tworzywa sztucznego (o szerokiej średnicy).
3) Próbkę wirować przy 200 x g przez 20 minut w temperaturze pokojowej (przez przerw). Po zakończeniu wirowania w probówce można zaobserwować 3 różne warstwy:
- dolna warstwa: czerwone krwinki (stanowiące 50-80% całkowitej objętości)
- warstwa środkowa: bardzo cienkie pasmo białych krwinek, zwane również „kożuszkiem”.
- warstwa wierzchnia: osocze bogatopłytkowe (słomkowego koloru) [20].
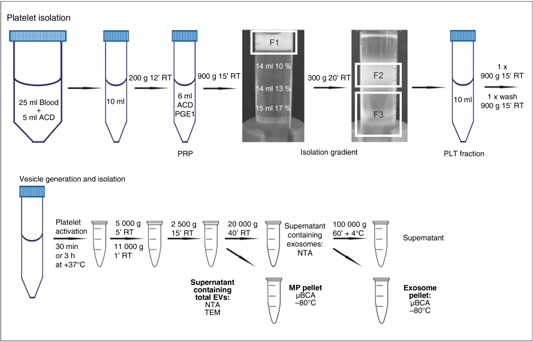
Izolacja płytek krwi (wirowanie w gradiencie gęstości)
Krew żylną pobrano od zdrowych ochotników, którzy wyrazili świadomą zgodę na udział w badaniu. Krew pobrano w warunkach laboratoryjnych, metodą zapobiegającą aktywacji płytek. Pierwsze 3 ml pobranej krwi odrzucono, a do kolejnych 25 ml dodano 5 ml antykoagulantu -kwaśnego cytrynianu dekstrozy (ACD, 39 mM kwas cytrynowy-75 mM cytrynian sodu- 135 mM [D]-glukoza, pH=4,5) (metoda izolacji modyfikowana przez Birschmann’a i wsp.). Kwaśny cytrynian dekstrozy poza zapobieganiem chelatacji wapnia w krwi co zapobiega aktywacji koagulacji, dodatkowo obniża pH krwi do 6.5. Płytki krwi nie agregują łatwo w takim pH. Zazwyczaj w procedurach izolacji dodawana jest 1 część antykoagulantu na 6 części krwi (1:6) [18],[19].
Poszczególne etapy izolacji wyszczególnione są poniżej.
W ciągu 20 minut od pobrania, osocze bogate w płytki krwi (PRP) otrzymano przez wirowanie przy 200 x g przez 12 minut w temperaturze pokojowej (RT). Po wirowaniu próbkę PRP przeniesiono do probówki polipropylenowej, po czym do próbki dodano 1/10 objętości ACD oraz 100 ng/ml prostaglandyny E1 (PGE1) w celu zapobiegnięcia aktywacji płytek krwi podczas izolacji.
Następnie osocze bogatopłytkowe odwirowano (900 x g, 15 minut w temperaturze pokojowej), po czym usunięto (odessano) otrzymane osocze. Płytki krwi zawieszono w 6 ml buforu HEPES-NaCl2 (10 mM Hepes, 0.85% NaCl, pH 7.4). Próbkę naniesiono na gradient 10-17% roztworu jodiksanolu w buforze HEPES-NaCl. Gradient odwirowano przy 300 x g przez 20 minut (temperatura pokojowa) bez przerwy, a dalej zebrano frakcję płytek.
Płytki krwi wirowano przy 900 x g przez 15 minut w temperaturze pokojowej, otrzymany osad przemyto (1x) i ponownie zawieszono w wolnym od Ca2+ buforze Tyroda-HEPES (137 mM NaCl- 0,3 mM NaH2PO4-3,5 mM Hepes-5,5 mM [D]-glukoza, pH 7,35). Na koniec określono stężenie płytek [18],[19].
LITERATURA:
[2]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.665-671
[3]. Josic D., Hoffer L., Buchacher A., Frenzel W. i wsp.,2000. Manufacturing of a prothrombin complex concentrate aiming at low thrombogenicity. Thrombosis Research 2000; 100: 433–441.
[4]. Levy H.J., Szlam F., Tanaka K.A. i wsp.,2012. Fibrynogen and Hemoostasis: A Primary
Hemostatic Target for the Management of Acquired Bleeding. Anesthesia Analgesia 2012; 114: 261–274.http://www.wim.mil.pl/images/stories/Wydawnictwa/Wytyczne_internet_aktywny_spis_treci.pdf
[5]. Wrzyszcz A.,2003. Matrix Metalloproteinases of Platelets. Adv. Clin. Exp. Med. 2003,
12, 6, 833–839. http://www.dbc.wroc.pl/Content/2351/R19-Wrzy.pdf
[6]. Fluo Cell Double Staining Kit (Calcein AM / PI), http://abo.com.pl/pl/p/Fluo-Cell-Double-Staining-Kit-Calcein-AM-PI/15067
[7]. Niemirowicz K., Żelazowska-Rutkowska B., Wysocka J., Car H., 2012. Platelet number disorders. diagnostyka laboratoryjna, Journal of Laboratory Diagnostics 2012 • Volume 48 • Number 4 • 455-460
[8].http://edraurban.pl:8080/book-sample-file/diagnostyka-laboratoryjna-w-weterynarii/pdf/093_110_r06_veterinarylabmed.pdf
[9]. Italiano J.E. Jr. The structure and production of blood platelets. Chapter 1. http://assets.cambridge.org/97805218/81159/excerpt/9780521881159_excerpt.pdf
[10]. Harrison P., 2005. Platelet functions analysis. Blood Reviews (2005) 19, 111–123. Oxford Haemophilia Centre & Thrombosis Unit, Churchill Hospital, Oxford OX3 7LJ, UK. http://www.uv.es/bacete/Histologia/Plaquetas_funcion.pdf
[11]. Bambace N.M., Holmes C.E., 2011. The platelet contribution to cancer progression. Journal of Thrombosis and Haemostasis ,9: 237–2. http://med.uvm.edu/lcbr/Downloads%5Cplatelets.pdf
[12]. Komosa A., 2013. Rozprawa doktorska. Ocena wartości prognostycznej wybranych parametrów klinicznych (Predict Score) oraz testu oporności płytek krwi na klopidogrel (Multiplate) w przewidywaniu zdarzeŃ niedokrwiennych u pacjentów po zabiegach przezskórnej interwencji wieńcowej. http://www.wbc.poznan.pl/Content/298663/index.pdf
[13]. http://biomed.brown.edu/Courses/BI108/BI108_2005_Groups/10/webpages/plateletslink.htm
[14]. Smorąg I., Baj Z., 2007. Niehemostatyczna rola płytek krwi. Zakład Patofizjologii i Immunologii Klinicznej Uniwersytetu Medycznego w Łodzi. http://www.diagnostykalaboratoryjna.eu/journal/DL_2008__2;_241-248.pdf
[15]. Saluk J., Bijak M., Ponczek M.B., Wachowicz B., 2014. Powstawanie, metabolizm i ewolucja płytek krwi. Postępy Hig Med Dosw (online), 2014; 68: 384-391
[16]. Immunologiczne zasady przetaczania koncentratów krwinek płytkowych (KKP). Rozdział 1. http://bip.rckik.radom.pl/wp-content/uploads/2014/09/Immunologiczne-Zasady-Przetaczania-KKP.pdf
[17]. Maślanka K., 2011. Współczesne poglądy na występowanie oporności na przetaczanie koncentratów krwinek płytkowych. Acta Haematologica Polonica 2011, 42, Nr 3, str. 453–465
[18].. AatonenM.T, ÖhmanT., NymanT.A., LaitinenS., GrönholmM., SiljanderP.R.-M., 2014. Isolation and characterization of platelet-derived extracellular vesicles. Journal of Extracellular Vesicles, Vol 3 (2014) incl supplements. http://www.journalofextracellularvesicles.net/index.php/jev/article/view/24692#F0001_24692
[19]. FRASER MUSTARD J., KINLOUGH-RATHBONE R.L., PACKHAM M.A.,1989. Isolation of Human Platelets from Plasma by Centrifugation and Washing. Methods in enzymology, Vol 169. http://ncxt.lbl.gov/files/paper/other_paper/platelet-isolation.pdf
[20]. http://www.abcam.com/protocols/isolation-of-human-platelets-from-whole-blood
[21]. Mustard J.F., Kinlough-Rathbone R.L., Packham M.A., 1989. Isolation of Human Platelets from Plasma by Centrifugation and Washing. Methods in Enzymology, VOL 169, http://ncxt.lbl.gov/files/paper/other_paper/platelet-isolation.pdf
Tagi: trombocyty, płytki krwi, ziarnistości, osocze bogatopłytkowe, PRP, przeciwciała płytkowe, okluzja, utrwalanie, cytometr przepływowy, liofilizacja, frakcjonowanie, megakariocyt, propłytki, proliferacja, trombopoetyna
wstecz Podziel się ze znajomymi









Recenzje