- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Rola Lactobacillus w zdolności do biosporcji jonów kadmu
Bakterie z rodzaju Lactobacillus, będące składowymi mikroflory błon śluzowych ludzi i zwierząt, są przykładem bakterii o właściwościach prozdrowotnych. Dzięki znamiennym właściwościom biologicznym bakterie te mogą chronić organizm gospodarza zarówno przed patogennymi mikroorganizmami, jak i metalami ciężkimi pochodzącymi ze środowiska. Duży wpływ na działanie ochronne lactobacilli wobec toksyczności pierwiastków wynika z budowy ich ściany komórkowej, w tym białek powierzchniowych. Niniejsza praca miała na celu określenie zdolności dwóch frakcji białek powierzchniowych: warstwy S (ang. S-layer) i białek związanych z warstwą S (SLAPs, ang. S-layer associated proteins) do usuwania jonów kadmu z roztworów wodnych. Eksperyment prowadzano z wykorzystaniem szczepu L. helveticus B734, zarówno w warunkach niedenaturujących, jak i denaturujących. W wyniku przeprowadzonych badań po raz pierwszy w przypadku tego gatunku bakterii wyizolowano i wstępnie scharakteryzowano białka SLAPs. Wykazano, że obie wyizolowane frakcje białek wykazują zdolność do biosorpcji jonów kadmu, z efektywnością w zakresie od 11 do 25,3% w zależności od badanej frakcji i obecności czynnika chaotropowego.
Kadm to metal ciężki, który w wyniku rozwoju cywilizacji i uprzemysłowienia stał się pierwiastkiem szeroko rozpowszechnionym w przyrodzie. Jego duża mobilność w glebie i wodzie stwarza zagrożenie przedostania się kadmu do roślin, co może prowadzić do włączenia pierwiastka do łańcucha troficznego ekosystemu. Biorąc pod uwagę dużą toksyczność kadmu dla organizmów żywych, w tym człowieka, wyzwaniem stało się poszukiwanie metod umożliwiających efektywną eliminację szkodliwych metali ze środowiska. Pomimo wielu dostępnych konwencjonalnych metod fizycznych, czy chemicznych, obiecującą alternatywą jest zastosowanie materiałów biologicznych do usuwania substancji z roztworów wodnych (ANSARI I IN., 2011). W proces ten, określany mianem biosorpcji zaangażowane mogą być mikroorganizmy, w tym bakterie kwasu mlekowego powszechnie wykorzystywane w produktach probiotycznych, które dzięki bezpieczeństwu stosowania mogą eliminować metale ciężkie również w organizmie człowieka. Liczne badania wskazują, że absorpcja jonów metali ciężkich jest efektem ich wiązania do poszczególnych komponentów ściany komórkowej, w tym białek powierzchniowych. Podczas gdy zasadnicza budowa białek powierzchniowych poszczególnych rodzajów bądź gatunków może być zbliżona, ich specyficzna rola w znacznym stopniu uzależniona jest od aktywności mikroorganizmu. Przykładowo, funkcja białek powierzchniowych szczepów patogennych różni się od tej pełnionej u bakterii probiotycznych, czy u mikroorganizmów występujących w różnych środowiskach (GERBINO I IN., 2015; HALTTUNEN I IN., 2007). Biorąc to pod uwagę zasadnym wydaje się więc poznanie właściwości sorpcyjnych bakterii, które często wchodzą w skład produktów mlecznych.
Niniejsza praca miała na celu określenie zdolności białek powierzchniowych bakterii Lactobacillus helveticus B734 do biosorpcji jonów kadmu. W badaniach uwzględniono zarówno białka warstwy S (ang. S-layer) oraz białka związane z warstwą S (SLAPs, ang. S-layer associated proteins).
Materiał i metody badań
Materiał do badań stanowił szczep Lactobacillus helveticus B734 wyizolowany z fermentowanych produktów mlecznych, pochodzący z polskiej kolekcji (Uniwersytet War-mińsko-Mazurski w Olsztynie, Polska).
Bakterie dwukrotnie pasażowano na podłoże MRS (BTL, Łódź) z dodatkiem 0,05% L-cysteiny. Płynną hodowlę inkubowano przez 48 godzin w temperaturze 37 °C w warunkach beztlenowych.
Izolacja białek powierzchniowych L. helveticus B734
Protokół izolacji stanowi zmodyfikowaną metodę izolacji białek powierzchniowych z hodowli L. acidophilus opisaną w pracach LORTAL I IN. (1992); GOH I IN. (2009); JOHNSON I IN. (2013). Bakterie hodowano w 2000 ml MRS (BTL, Łódź) przez 24 h, następnie biomasę odwirowano (18 000 x g, 20 min, 4 °C) i dwukrotnie przemyto zimnym buforem PBS (na 1 g komórek użyto 5 ml buforu PBS). Bakterie w celu dokładnego pozbycia się podłoża hodowlanego, wytrząsano w buforze PBS przez 15 minut, po czym dokładnie zwirowano (18000 x g, 20 min, 4 °C). Bakterie inkubowano w 5 M LiCl przez 60 minut w temperaturze 4 °C (1 g komórek zawieszono w 5 ml 5 M LiCl), po czym supernatant zawierający białka powierzchniowe S-layer i SLAPs odwirowano i dializowano w membranie ZelluTrans Roth 3,5 (MWCO 4,000-6,000; Nominal Filter Rating 3,500; Carl Roth GmbH) przez 2 doby w 4 °C. Uzyskany pelet wytrząsano w 20 ml 1 M LiCl w 4 °C przez dobę. Po wirowaniu (20 000 x g, 1 h), otrzymany pelet stanowiący białka S, zawieszono w 10 ml wody ultraczystej.Supernatant poddano dializie w membranie ZelluTrans Roth 3,5 (MWCO 4,000-6,000; Nominal Filter Rating 3,500; Carl Roth GmbH) przez 2 doby w temperaturze 4 °C. W ten sposób otrzymano białka SLAPs. Białka zawieszone w wodzie ultraczystej poddano liofilizacji i przechowywano w temperaturze -20 °C do dalszych badań.
Stężenie wyizolowanych frakcji określono z wykorzystaniem zestawu odczynników Micro BCA Protein Kit (Thermo Scientific, USA) zgodnie z procedurą podaną przez producenta. Pomiar absorbancji wykonano za pomocą czytnika Sunrise (Tecan, Szwajcaria) przy długości fali 562 nm. Stężenie próbek obliczono z krzywej standardowej wyznaczonej na podstawie absorbancji standardów.
Otrzymane dwie frakcje białek powierzchniowych scharakteryzowano z wykorzystaniem elektroforezy SDS-PAGE wg metody Laemmli (1970). Masy cząsteczkowe uzyskanych prążków określono za pomocą systemu GS800 (BioRad, USA).
W celu oczyszczenia białek powierzchniowych zastosowano metodę chromatografii wykluczania SEC (SEC, Sephacryl S-100 HR, Sigma-Aldrich) w systemie FPLC (BioLogic LP unit, Model 2110 Fraction Collector, Bio-Rad, USA). Uzyskane w wyniku izolacji białka powierzchniowe o masach 10 mg zmieszano i rozpuszczono w 20 ml 6 M mocznika. Rozdział przeprowadzono z natężeniem przepływu wynoszącym 0,5 ml/min w objętości eluentu wynoszącej łącznie 520 ml.
Eksperyment biosorpcji jonów kadmu przez białka powierzchniowe L. helvetius B734
Przed przystąpieniem do eksperymentu biosorpcji przygotowano roztwory białek S i SLAPs o stężeniu 1 mg/ml zawieszone w wodzie ultraczystej dla uzyskania warunków niedenaturujących, a w 10 M moczniku – warunków denaturujących. Przygotowano również odważkę soli kadmu w celu otrzymania roztworu Cd2+ o stężeniu10 µg/ml.
Proces dializy przeprowadzono w 50 ml roztworu jonów kadmu (II). Zawieszone w wodzie lub rozpuszczone w moczniku białka przeniesiono do przygotowanych uprzednio membran dializacyjnych. Do jednej z membran wprowadzono 1 mlwody ultraczystej lub 10 M mocznika, co stanowiło próbę kontrolną. Tak przygotowane membrany umieszczono w oddzielnych falkonach zawierających roztwór metalu i prowadzono eksperyment biosorpcji przez 2 godziny przy wytrząsaniu 200 RPM w 37 °C. Po tym czasie zebrano po 2 ml roztworu zewnętrznego oraz zawiesinę białek z membrany dializacyjnej z każdej próby do pomiaru stężenia kadmu, który oznaczono przy użyciu atomowego spektrometru absorpcyjnego.
Pojemność sorpcyjną q (µg metalu/mg białka) oraz efektywność usuwania metalu RE (%) obliczono na podstawie wzorów przedstawionych poniżej:
gdzie: ci to początkowe stężenie metalu (µg/ml), ce – końcowe stężenie metalu w każdej próbce (µg/ml), V – objętość (ml) i m (mg) - sucha masa białek.
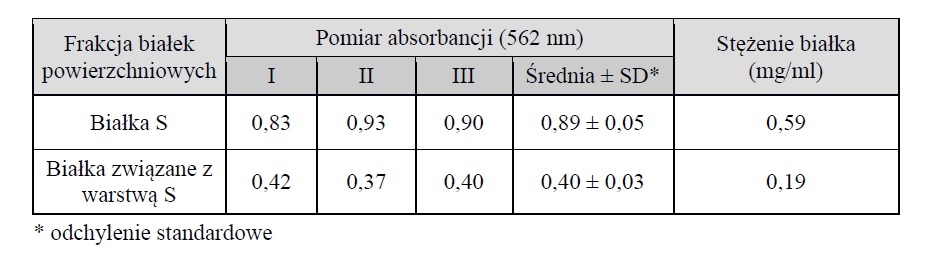
Analiza oceny zdolności białek powierzchniowych do biosorpcji jonów metali wymaga ich wcześniejszej izolacji. Ekstrakcja przebiega najczęściej z wykorzystaniem wysokiego stężenia soli jak hydrochlorek guanidyny, czy chlorek litu, które rozrywają wiązania wodorowe pomiędzy białkami S a drugorzędowymi polisacharydami tworzącymi ścianę komórkową bakterii. Działanie chlorkiem litu o stężeniach 1 M i 5 M w celu efektywnej izolacji białek warstwy S u różnych gatunków bakterii z rodzaju Lactobacillus zostało potwierdzone w kilku pracach (LORTAL I IN., 1992; SMIT I IN., 2001; FRECE I IN., 2005; GOH I IN., 2009; ASHIDA I IN., 2011; BEGANOVIĆ I IN., 2011; TAVERNITI I IN., 2013). Nadal jednak niewiele jest prac dotyczących izolacji i analizy egzoprotein związanych z warstwą S (JOHNSON I IN., 2013). W przeprowadzonych w niniejszej pracy badaniach w celu oddzielenia frakcji białek powierzchniowych wykorzystano ich różnice w rozpuszczalności w 1 M LiCl. Nierozpuszczalne białka warstwy S wyekstrahowano z mieszaniny po 24-godzinnej inkubacji w ww. roztworze, podczas gdy JOHNSON I IN. (2013) prowadzili proces izolacji tych białek z L. acidophilus NCFM przez jedynie 15 minut. Różnice w metodyce obserwowano także podczas wirowania próbek zawierających białka, które każdorazowo wydłużano dwukrotnie, co było wynikiem ich słabej przyczepności. Przeprowadzone badania własne pozwoliły na ekstrakcję dwóch, zróżnicowanych pod względem właściwości fizykochemicznych frakcji białek powierzchniowych u szczepu L. helveticus B734: Slp (ang. S-layer protein) i SLAPs. W wyniku pomiaru absorbancji wykazano, że po izolacji białek powierzchniowych z 2 litrów hodowli (1% inokulum) uzyskano 0,59 mg/ml białek S oraz 0,19 mg/ml SLAPs (Tabela 1).
Tabela 1. Pomiar absorbancji próbki przy długości fali 562 nm.
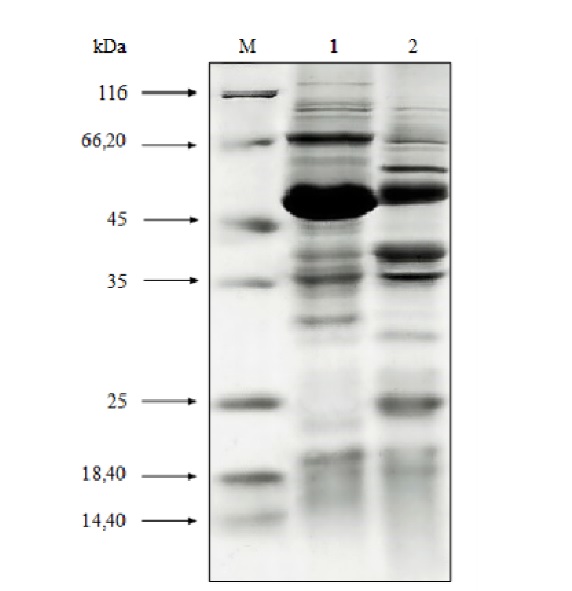
Identyfikację białek powierzchniowych przeprowadzono metodą elektroforetyczną w obecności czynnika denaturującego – dodecylosiarczanu sodu. Uzyskano profil elektroforetyczny zawierający liczne prążki o szerokim zakresie mas cząsteczkowych, które różniły się w zależności od analizowanej frakcji białek (Rysunek 1).
W przypadku białek S, podobnie jak w badaniach WAŚKO I IN. (2014), przeprowadzony rozdział pozwolił uzyskać prążek charakterystyczny dla badanej frakcji o masie cząsteczkowej wynoszącej ok. 49 kDa. Na obrazie żelu białek SLAPs obserwowano liczne prążki, których niekiedy nie zaobserwowano po elektroforetycznym rozdziale białek S, pozwala to wnioskować, że mogą to być prawdopodobnie białka związane z warstwą S. Należy też dodać, że pomimo tych samych mas cząsteczkowych, analizowane białka mogą być różnymi proteinami, o zróżnicowanym punkcie izoelektrycznym. Z drugiej jednak strony można domniemywać, że białka niskocząsteczkowe, które zaobserwowano w obu ścieżkach mogą stanowić białka SLAPs. W celu potwierdzenia tych przypuszczeń niezbędne byłoby przeprowadzenie dalszych badań polegających na sekwencjonowaniu uzyskanych w wyniku ekstrakcji chlorkiem litu białek.

Rys. 1. Profil elektroforetyczny SDS-PAGE białek powierzchniowych L. helveticus B734 wyizolowanych przy pomocy chlorku litu. M: marker mas; 1: białka warstwy S; 2: białka związane z warstwą S.
Należy podkreślić, że podczas gdy rola białek S-layer we właściwościach powierzchniowych lactobacilli jest coraz częściej badana i opisana przez wielu autorów (BEGANOVIĆ I IN., 2011; SUN I IN., 2013; HYNÖNEN I IN., 2014; LIU I IN., 2011), niewiele jest szczegółowych prac pokazujących potencjał probiotyczny SLAPs, który może okazać się niezwykle istotny. Z tego też względu wstępna identyfikacja tych białek stanowi pierwszy krok w celu zrozumienia funkcji bakteryjnych białek powierzchniowych i zapewni tym samym lepsze spojrzenie na budowę i fizjologię powierzchni komórkowej bakterii z rodzaju Lactobacillus.
Z danych literaturowych wynika, że zdolność lactobacilli do wiązania i usuwania jonów metali jest skorelowana z występowaniem u nich białek powierzchniowych warstwy S. Laboratoryjne metody badawcze z tego zakresu opierają się m.in. na wykorzystaniu membran dializacyjnych zawierających białka, które inkubowane są w odpowiednich warunkach w roztworze metalu. Efektywność usuwania metali ocenia się poprzez zmianę stężenia pierwiastka w roztworze w porównaniu do kontroli po wyznaczonym czasie eksperymentu (POLLMANN I MATYS, 2007). Parametrem pozwalającym określić przydatność biosorbentu może być pojemność sorpcyjna (q), która wyraża masę jonów metalu zaadsorbowanych w suchej masie biosorbentu w stosunku do aktualnego stężenia w roztworze wodnym (SUHR I IN., 2014).
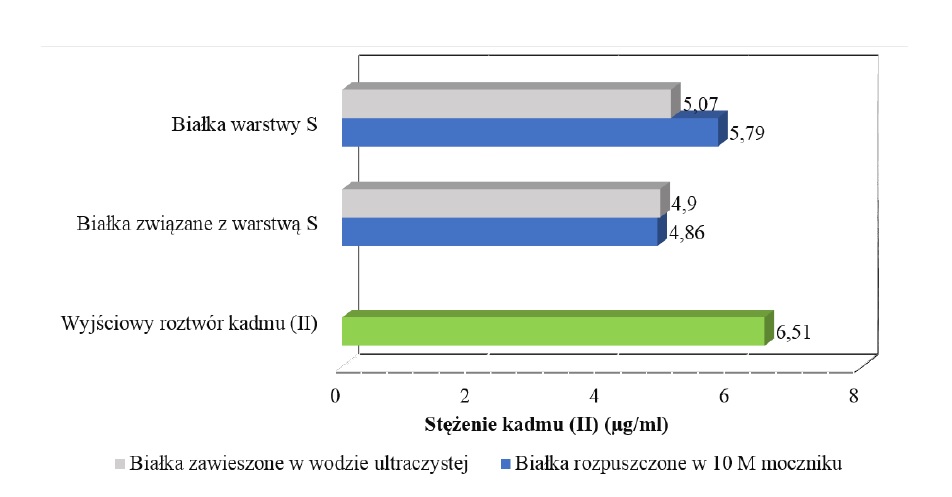
Przeprowadzone badania dotyczące wiązania jonów kadmu przez białka powierzchniowe wykazały, że zarówno białka warstwy S, jak i białka związane z warstwą S są zdolne do ich usuwania. Mianowicie, w wyniku dwugodzinnej inkubacji białek w roztworze kadmu(II) uzyskano spadek stężenia metalu w zakresie od 11 do 25,3% (Rysunek 2).
Rys. 2. Zmiana stężenia jonów kadmu w roztworze wyjściowym oraz po biosorpcji jonów kadmu przez białka powierzchniowe L. helveticus B734.
Biosorpcję jonów metali przez warstwę powierzchniową komórek bakterii z rodzaju Lactobacillus potwierdzili też inni autorzy ( MRVČIĆ I IN., 2009, 2012; DOHM I IN., 2011; SCHUT I IN., 2011; GERBINO I IN., 2012, 2015).
SCHUT I IN. (2011) wykazali, że bakterie L. hilgardii DSM 20176 traktowane proteinazą K, a co za tym idzie pozbawione warstwy S cechowały się mniejszą zdolnością do wiązania jonów miedzi w porównaniu do tych samych bakterii z warstwą S na powierzchni komórki. Z kolei GERBINO I IN. (2015) badając biosorpcję ołowiu przez L. kefir zauważyli, że białka powierzchniowe mogą stanowić raczej barierę ochronną przed jonami metalu, a większą rolę w jego usuwaniu w porównaniu do białek mogą pełnić inne komponenty komórkowe, takie jak np. oligosacharydy.
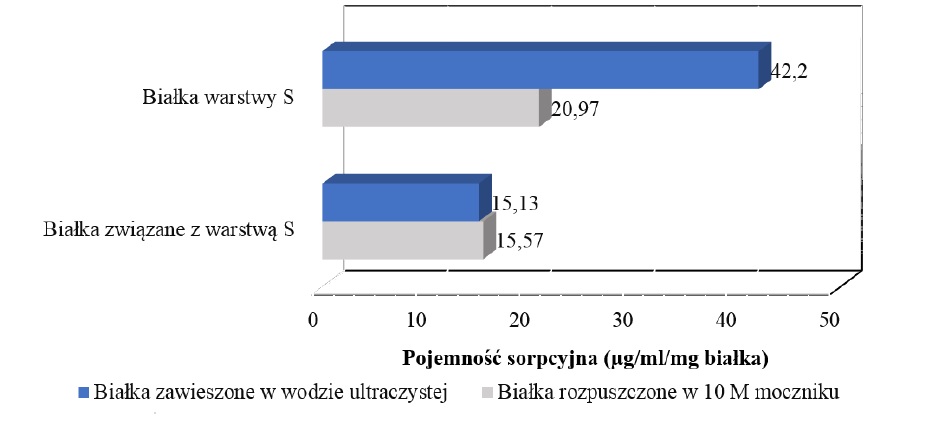
Przeprowadzone badania wykazały, że pojemność sorpcyjna w przypadku białek warstwy S w środowisku wodnym była dwukrotnie wyższa (42,2 µg/ml na mg białka) niż w sytuacji, gdy te same białka rozpuszczono w czynniku chaotropowym (10 M mocznik) (Rysunek 3).
 Rys. 3. Porównanie pojemności sorpcyjnej białek powierzchniowych L. helveticus B734 w środowisku wodnym oraz z czynnikiem chaotropowym.
Rys. 3. Porównanie pojemności sorpcyjnej białek powierzchniowych L. helveticus B734 w środowisku wodnym oraz z czynnikiem chaotropowym.
Na podstawie uzyskanych wyników można przypuszczać, że powstałe różnice są spowodowane wartością odczynu środowiska, w którym prowadzono proces, co wpływa na aktywność grup funkcyjnych zaangażowanych w interakcję metal-bakteria. Bowiem, na podstawie przeprowadzonych analiz molekularnych uważa się, że usuwanie metali ciężkich zachodzi na powierzchni bakterii głównie za pomocą oddziaływań elektrostatycznych z grupami fosforanowymi i karboksylowymi (HALTTUNEN i IN., 2008). Potwierdziły to badania przeprowadzone na wyizolowanych z komórki białkach S-layer, które wykazały, że te specyficzne struktury zdolne są do oddziaływania z metalami poprzez grupy karboksylowe reszt kwasu asparaginowego i glutaminowego (GERBINO I IN., 2011). Tak więc, gdy reakcja przebiegała w środowisku wodnym o odczynie 6,21, grupy karboksylowe uczestniczące w wiązaniu jonów kadmu były naładowane ujemnie, co zwiększyło wydajność procesu, zaś w przypadku zastosowania 10 M mocznika o pH 7,36 prawdopodobnie nastąpił spadek rozpuszczalności jonów metalu i mogło dojść do ich precypitacji. Powyższe procesy opisane w kilku pracach wskazują jednocześnie, że największa wydajność biosorpcji osiągana jest w pH o wartości 5 (IBRAHIM I IN., 2006; MRVČIĆ I IN., 2009; SCHUT I IN., 2011).
Duży udział pH w wiązaniu jonów metali potwierdza fakt, że pomimo zastosowania czynnika chaotropowego, który powoduje rozfałdowanie struktury białek i powinien ułatwiać dostępność grup funkcyjnych do jonów metalu, czyniąc białko bardziej podatne na ich wiązanie, lepsze usuwanie metalu przez białka warstwy S następowało przy niższej wartości odczynu środowiska.
Co ciekawe, po dwugodzinnym eksperymencie pojemność sorpcyjna białek SLAPs w obu przypadkach była bardzo zbliżona i wynosiła ok. 15 µg/ml na mg białka, co odpowiadało 25% efektywności usuwania jonów kadmu z roztworu. Uwzględniając inne właściwości fizykochemiczne tej frakcji niż warstwy S można przypuszczać, że białka SLAPs wpływają ochronnie na zmieniające się warunki procesu, jednak wymaga to jeszcze dokładnego zbadania.
Tagi: biosorpcja, kadm, bakterie kwasu mlekowego, białka warstwy S, białka związane z warstwą S.
wstecz Podziel się ze znajomymi









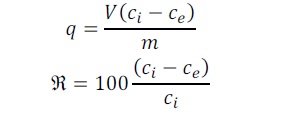
Recenzje