- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Azotowe i tlenowe związki heterocykliczne
Związki heterocykliczne to związki organiczne o budowie pierścieniowej, w których jeden bądź więcej atomów pierścienia stanowi heteroatom. Cząsteczki heterocykli składają się z jednego pierścienia aromatycznego bądź skondensowanych pierścieni aromatycznych, połączonych jedną lub kilkoma ścianami. Układy te mogą być całkowicie bądź częściowo uwodornione. Związki heterocykliczne występują zarówno w organizmach zwierzęcych jak i roślinnych, gdzie spełniają istotne funkcje fizjologiczne. Otrzymywane są także syntetycznie w przemyśle farmaceutycznym oraz przemyśle barwnikarskim.
Słowa kluczowe: związki heterocykliczne, chemia organiczna
Wstęp
Heterocykliczne związki organiczne to związki, w których co najmniej jeden atom w pierścieniu musi być heteroatomem, czyli atomem innego niż węgiel pierwiastka. Najczęściej spotykanymi heteroatomami są azot, tlen i siarka, chociaż znane są również pierścienie heterocykliczne zawierające atomy pierwiastków takich jak bromu, fosforu, krzemu, arsenu, cyny i telluru [3]. Pierścienie heterocykliczne są bardzo zróżnicowane pod względem budowy. Mogą mieć różne wielkości, posiadać wiązania wielokrotne, mogą być połączone łańcuchami bądź pierścieniami [2].
Podział związków heterocyklicznych opiera się na kształcie pierścienia oraz ilości heteroatomów.
W związku z tym wyróżniamy:
• Pięcioczłonowe układy pierścienie heterocykliczne
- z jednym heteroatomem;
- z dwoma lub większa liczbą heteroatomów;
- z jednym heteroatomem;
- z dwoma lub większa liczbą heteroatomów;
Wśród związków heterocyklicznych na szczególną uwagę zasługują heterocykliczne związki azotu i tlenu.
Pięcioczłonowe układy pierścienie heterocykliczne z jednym heteroatomem
Do najważniejszych pięcioczłonowych związków heterocyklicznych z jednym heteroatomem należą:
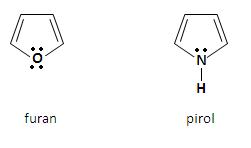
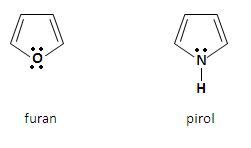
Aromatyczny charakter furanu i pirolu jest wynikiem delokalizacji czterech elektronów π atomów węgla, jak również niewiążącej pary elektronowej heteroatomu. Powstaje sekstet zdelokalizowanych elektronów, który jest charakterystyczny dla układów aromatycznych. Za pomocą orbitali atomowych strukturę omawianych heterocykli można przedstawić w postaci płaskiego pięciokątnego szkieletu, który zbudowany jest z wiązań σ C – H, C – C i C – Z (Z to heteroatom), utworzonych przez atomy węgla o hybrodyzacji sp2. Cztery orbitale p atomów węgla, które obsadzone są przez cztery elektrony π, jak również orbital p heteroatomu, obsadzony przez niewiążącą parę elektronową, nakładają się tworząc zdelokalizowany orbital molekularny [3].
Furan ma płaską, pentagonalną strukturę. Każdy atom, który wchodzi w skład pierścienia jest w stanie hybrydyzacji sp2 i angażuje dwa z tych orbitali do utworzenia wiązań σ ze swoimi sąsiadami. Ponadto każdy atom węgla angażuje również jedną orbitę sp2 by utworzyć wiązanie z atomem wodoru z płaszczyźnie pierścienia. W ten sposób jeden elektron znajduje się na orbitalu p prostopadłym do płaszczyzny. Z kolei atom tlenu ma niewiążąca parę elektronową na orbitalu sp2 w płaszczyźnie pierścienia, a także dwa elektrony na orbitalu p prostopadłym do płaszczyzny Charakter aromatyczny pierścienia. Oba elektrony nakładają się z orbitalami p atomów węgla, w wyniku czego tworzy się chmura sekstetu elektronów π, która usytuowana jest na i pod płaszczyzną pierścienia. Wiązania w pirolu są podobne do tych w furanie [2].

Pirol wykazuje słabe właściwości kwasowe, tworząc sole z metalami alkalicznymi. Stałą dysocjacji kwasowej pirolu określa się szacunkowo na 10-15. Furan pod wpływem bardzo mocnych zasad, takich jak między innymi fenylosód, tworzy związki metaloorganiczne. Powstają one poprzez podstawianie atomów wodoru związanych z węglem w pozycji 2 pierścienia heterocyklicznego.
Właściwości zasadowe furanu i pirolu są trudne do określenia, ze względu na fakt, iż oba te związki ulegają polimeryzacji pod wpływem kwasów. Zarówno furan jaki i pirol ulegają reakcjom substytucji elektrofilowej [3]. Ze względu na fakt, iż układy te są wrażliwe na działanie silnych kwasów (pod ich wpływem układy ulegają rozpadowi z otwarciem pierścienia lub wykazują tendencję do polimeryzacji) unika się stosowania silnych kwasów. Nitrowanie prowadzone jest więc w obecności bezwodnika octowego, sulfonowanie zazwyczaj używając trójtlenku siarki w pirydynie (warunki zasadowe), natomiast do reakcji acylowania Friedela-Craftsa nie stosuje się katalizatora, który jest silnym kwasem Lewisa. Pięcioczłonowe heterocykle charakteryzują się również bardzo dużą wrażliwością na działanie środków utleniających. Utleniają się już z tlenem z powietrza, w wyniku czego powstają ciemnozabarwione, polimeryczne pochodne. Redukcja możliwa jest na drodze katalitycznej (do układów nasyconych) lub do dihydropochodnych [1].
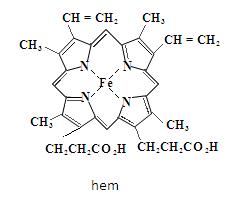
Pierścienie pirolu to ważne elementy struktury wielu istotnych z biologicznego punktu widzenia barwników. Przykładem jest porfiryna – makrocykliczny związek, zawierający cztery pierścienie pirolu połączonych jednowęglowym mostkiem. Są to płaskie cząsteczki, w których występuje sprzężony układ 18 elektronów π. Porfiny są bardzo trwałe, silnie zabarwione oraz tworzą kompleksy z jonami metali. W tego typu kompleksach nie ma już atomów wodoru, które w porfinie były związane z dwoma atomami azotu, z kolei każdy z czterech atomów azotu oddaje swoją parę elektronowa do metalu, umiejscowionego w środku struktury cząsteczki. Porfina nie występuje w przyrodzie w stanie wolnym, jednakże jej analogi z podstawionymi pierścieniami pirolowymi zalicza się do jednych najważniejszych dla procesów życiowych związków występujących w naturze. Przykładem jest hem – porfirynowy kompleks z żelazem, który odpowiedzialny jest za czerwony kolor krwi tętniczej. Hem znajduje się w erytrocytach w postaci kompleksu z białkiem – globiną. Kompleks ten nazywa się hemoglobiną i odpowiada za wiązanie cząsteczkowego tlenu przez krew oraz transportowanie go do miejsc w organizmie, gdzie jest potrzebny [2].
Pięcioczłonowe pierścienie heterocykliczne z dwoma lub większą liczbą heteroatomów
W przypadku pięcioczłonowych związków heterocyklicznych istnieje możliwość wprowadzanie większej liczby (dwóch, trzech a nawet czterech) heteroatomów do pierścienia. Do najczęściej spotykanych tego typu układów, występujących w wielu produktach naturalnych i syntetycznych należą:
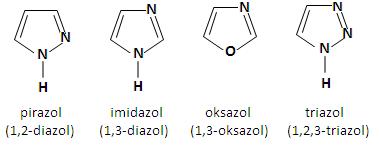
W zawiązku z tym, iż w cząsteczce pirazolu, imidazolu oraz triazolu, jeden z atomów azotu jest połączony z atomem wodoru, można oczekiwać dwóch izomerycznych jednopodstawionych pochodnych każdego z tych związków.
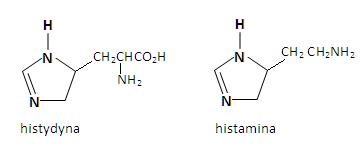
W cząsteczce imidazolu wolna para elektronowa azotu w pozycji 3 nie wchodzi do aromatycznego układu sekstetu elektronów π. W związku z tym, atom azotu N3 wykazuje charakter zasadowy i może być protonowany. Jon imidazoliowy jest bardzo stabilny, ponieważ ładunek dodatni może zostać równomiernie rozłożony na dwa atomy azotu. Układ ten występuje powszechnie w przyrodzie. Szkielet imidazolowy występuje w aminokwasie histydynie, gdzie odgrywa istotną rolę w reakcjach wielu enzymów. Dekarboksylacja histydyny powoduje powstanie histaminy – toksycznej substancji występującej w połączeniu z białkami w tkankach organizmu [2].
Sześcioczłonowe pierścienie heterocykliczne z jednym heteroatomem
Wśród sześcioczłonowych układów heterocyklicznych z jednym heteroatomem w pierścieniu do najważniejszych zalicza się pirydyna z atomem azotu, jak również pochodne α- i γ-piranu z atomami tlenu jako heteroatomami:
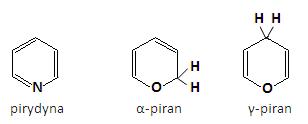
Pirydyna posiada właściwości aromatyczne w związku z delokalizacją sześciu elektronów π, po jednym z każdego z pięciu atomów węgla oraz jednego pochodzącego z atomu azotu [3]. Atom azotu jest w stanie hybrydyzacji sp2 i posiada jedne elektron na orbitalu p prostopadłym do płaszczyzny pierścienia. Elektron ten uzupełnia układ elektronów pochodzących od atomu węgla do sześciu w wyniku czego tworzą razem aromatyczna chmurę elektronów π nad i pod płaszczyzną pierścienia. Natomiast niezaangażowana w wiązania wolna para elektronów azotu znajdująca się na orbitalu sp2 leży w płaszczyźnie pierścienia.
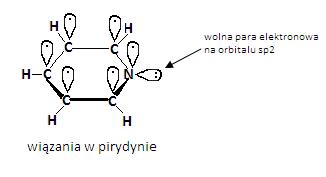
Cząsteczka pirydyny jest płaska, o niemal idealnej heksagonalnej geometrii. Ze względu, iż jest to związek aromatyczny, jest on bardziej podatny na reakcje podstawiania niż addycji. Pirydyna jest słabo zasadowa. Związek ten jest dużo słabszą zasadą niż aminy alifatyczne. Wynika to z różnicy hybrydyzacji atomu azotu: sp2 w pirydynie natomiast sp3 w aminach alifatycznych. Ze względu na silniejszy charakter typu s orbitalu zawierającego wolną parę elektronową, w pirydynie para ta znajduje się bliżej jądra atomu azotu, co przyczynia się do obniżenia jej zasadowości. Ponadto pirydyna reaguje z mocnymi kwasami, w wyniku czego powstają sole pirydynowe. Właściwość ta pozwoliła na zastosowanie jej jako czynnika wiążącego kwas w tych reakcjach, w których w których kwas wydziela się jako produkt uboczny.
Atom azotu przyciąga elektrony silniej niż węgiel, przez co następuje przesunięcie elektronów od atomów węgla pierścienia w kierunku azotu. Atom azotu posiada więc cząsteczkowy ładunek ujemny, natomiast atomy węgla pierścienia – cząsteczkowy ładunek dodatni. Taka polarność zwiększa rozpuszczalność pirydyny w rozpuszczalnikach polarnych, takich jak woda. [2].
Pirydyna występuje w smole pogazowej, z kolei wiele jej analogów i pochodnych znajduje się w przyrodzie. Pierścień pirydynowy wchodzi w skład alkaloidów takich jak nikotyny czy ryciny (w nasionach rącznika). Uwodorowany pierścień możemy znaleźć w alkaloidach palmy areki (np. arekaidyna), w koniinie czy też lobelinie. Pirydyna może również zostać zostać zredykowana do nasyconej drugorzędowej aminy – piperydyny:
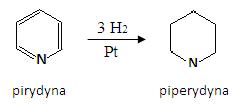
Układy pirydynowe i piperydynowe występują w wielu produktach pochodzenia naturalnego. Przykładem może być nikotyna (główny alkaloid znajdujący się w tytoniu, bardzo toksyczny dla człowieka, w rolnictwie stosowany jako insektycyd), koniina (główny, toksyczny składnik trucizny cykuty) i tydoksyna (koenzym, witamina B6).
Sześcioczłonowe pierścienie heterocykliczne z dwoma lub większą liczbą heteroatomów
Znane są liczne sześcioczłonowe układy heterocykliczne zawierające więcej niż jedne heteroatom w pierścieniu. Przykładem są trzy diazyny:

Wśród tych związków najważniejszą grupę stanowi pirymidyny. Ich pochodne: cytozyna, tymina i uracyl są ważnymi zasadami w kwasach nukleinowych (DNA i RNA).
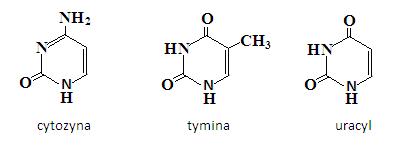
Pirymidyna jest zasadą jeszcze słabszą niż pirydyna, a jej atomy węgla w pierścieniu są o wiele mniej podatne na atak elektrofilowy niż atomy węgla występujące w cząsteczce pirydyny.
Znane są również triazyny oraz tetrazyny, natomiast nie spotyka się pentazyn, ani heksazyn [3].
Związki zawierające skondensowane pierścienie heterocykliczne
Skondensowane heterocykliczne układy pierścieniowe najczęściej zawierają w swoich cząsteczkach atomy azotu. Do najważniejszych tego typu układów zalicza się: indol, chinolina, izochinolina, puryna, i pterydyna. Każdy z tych związków wyodrębnia się ze smoły pogazowej. Znalazły one zastosowanie jako substraty do produkcji barwników, a niektóre z nich do produkcji leków [3].
Pierścień pirydynowy może zostać połączony z pierścieniem benzenowym, w wyniku czego powstają aromatyczne policykliczne heterocykle. Do najważniejszych przedstawicieli tej grupy związków zalicza się chinolina i izochinolina. Związki te są analogami naftalenu, gdyż atom azotu zastępuje grupę CH w pozycji C1 bądź C2:
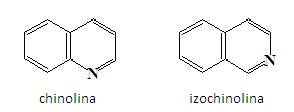
Pierścienie chinolinowe i izochinolinowe występują w wielu produktach pochodzenia naturalnego. Przykładem jest chinina (znajduje się w korze chinowej, stosowana w leczeniu malariii) i pepaweryna (obecna w opium, stosowana jako środek rozluźniający mięśnie) [2].
Do podwójnego wiązania związków heterocyklicznych mogą zostać dołączone inne pierścienie aromatyczne lub heteroaromatyczne. Przykładem może być indol – związek, w którym do wiązania C2 – C3 pirolu dołączony jest benzen:
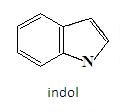
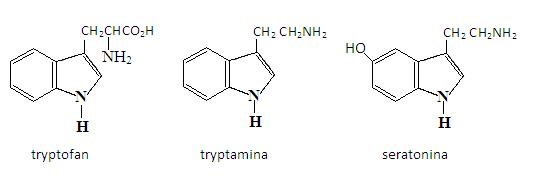
Pierścieniowy układ indolu można spotkać w wielu produktach naturalnych. Powstaje on w biosyntezie tryptofanu, który wchodzi w skład białek. Indol, jak również jego pochodna skatol, tworzą się podczas rozkładu białek.
W wyniku dekarbksylacji tryptofanu powstaje tryptamina. Wiele związków, w których występuje jej szkielet spełnia bardzo istotne znaczenia dla funkcjonowania systemu nerwowego i mózgu. Jednym z przykładów jest serotonina (5-hydroksytryptamina), która działa jako aktywny przekaźnik oraz czynnik wiążący naczynia w centralnym ośrodku nerwowym.
Kolejną ważną biologicznie klasą związków ze skondensowanymi pierścieniami heterocyklicznymi stanowią puryny. Zawierają one szkielet, w skład którego wchodzi pierścień pirymidynowy skondensowany z pierścieniem imidazolowym:
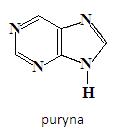
W pięcioczłonowym heterocyklicznym pierścieniu imidazolowym, znajdują się dwa atomy azotu, z których jeden w pozycji 7 (N7) jest zasadowy, ze względu na występowanie wolnej pary elektronowej, niewchodzącej do aromatycznego sekstetu elektronów π, ten atom azotu może być uprotonowany. Z kolei drugi atom azotu pierścienia imidazolowego N9 nie jest zasadowy, gdyż jego wolna para elektronowa wchodzi w skład sekstetu elektronów π, analogicznie jak atom azotu w pierścieniu pirolowym [4].
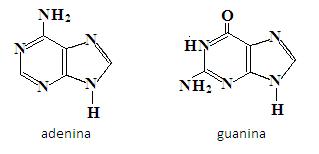
Najważniejszymi purynami występującymi w przyrodzie jest adenina i guanina. Są to zasady, które wchodzą w skład kwasów nukleinowych (DNA i RNA):
Wiele azotowych związków heterocyklicznych odgrywa istotną rolę w medycynie. Jednym z takich związków jest morfina (główny alkaliod występujący w opium). Morfina jest środkiem przeciwbólowym, który łagodzi ból, przy czym nie powoduje utraty przytomności [3].
Znane są również analogi naftalenu z więcej niż jednym atomem azotu. Związkiem takim jest pterydyna:
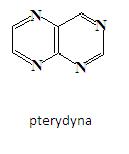
Pierścień pterydynowy, z atomami azotu, które zastąpiły CH naftalenu w pozycjach C1, C3, C5 i C8, występują w wielu produktach pochodzenia naturalnego, takich jak kwas foliowy (witamina, której niedobór powoduje niedokrwistość) lub ksantopteryna (barwnik skrzydeł motyli) [3].
Podsumowanie
Związki heterocykliczne to największa klasa związków organicznych. Wiele produktów naturalnych oraz większość leków posiada pierścienie heterocykliczne. Antybiotyki, barwniki kwiatów i innych roślin, związki transportujące tlen do różnych narządów naszego organizmu, jak również składniki DNA to związki heterocykliczne.
Podział heterocykli opiera się na kształcie pierścienia oraz ilości heteroatomów. W związku z tym wyróżniamy pięcioczłonowe układy heterocykliczne, sześcioczłonowe układy heterocykliczne oraz skondensowane pierścienie heterocykliczne. Typowymi heteroatomami są azot i tlen.
Główną różnica pomiędzy piecioczłonowymi i sześcioczłonowymi heterocyklami aromatycznymi jest to, że w pięcioczłonowych heterocyklach heteroatom angażuje dwa elektrony do aromatycznego sekstetu elektronów π, natomiast w sześcioczłonowych heterocyklach heteroatom angażuje tylko jeden elektron do takiego układu. Ma to istotne znaczenia dla chemicznych właściwości tych dwóch typów heterocykli.
Autor: Monika Duszyńska
Literatura:
1. Eicher, T.; Hauptmann, S. 2003. The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications.
2. Hart h., Craine L.E., Hart D., Hadad C.M. 2008. Chemia organiczna. Krótki kurs. Wyd. PZWL, 403-421.
3. Kupryszewski G., 1988. Wstęp do chemii organicznej. Wyd. PWN, 425-442.
4. Żak I, Balcerzyk A. 2001. Chemia medyczna. Śląska Akademia Medyczna, 307-324









Recenzje