- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Metody wyodrębniania z komórek oraz badanie właściwości białek, cz. I
Słowa kluczowe: białka, charakterystyka białek, właściwości białek, izolacja białek, precypitacja, liza, wysalanie, detergenty, dializa, homogenizacja
Białka zbudowane są z aminokwasów (ułożonych liniowo), połączonych między sobą tzw. wiązaniami peptydowymi. Wiązanie to powstaje między grupą α-aminową jednego aminokwasu a grupą α-karboksylową kolejnego. W momencie gdy dwa aminokwasy zostają połączone ze sobą powstaje tzw. dipeptyd, który na końcach posiada wolną grupę aminową i karboksylową-dzięki czemu możliwe jest przyłączenie kolejnego aminokwasu. Długie i nierozgałęzione łańcuch aminokwasów mogą łączyć się ze sobą wiązaniami peptydowymi, aż do momentu utworzenia łańcucha oligopeptydów (tj. do 25 reszt aminokwasów) lub polipeptydów (tj. do > niż 25 reszt aminokwasów). Utworzony łańcuch polipeptydowy ma zdolność fałdowania się, co powoduje powstawanie specyficznego kształtu danego białka- różnej jego konformacji. Konformacją nazywa się przestrzenne ułożenie atomów w strukturze, tak więc w przypadku białek wyróżnia się ich 4 struktury: strukturę I, II, III i IV-rzędową [2], [5].
Struktura pierwszorzędowa określana jest jako liniowa sekwencja aminokwasów, które połączone są wiązaniami peptydowymi. Struktura II-rzędowa przedstawiana jest jako regularne pofałdowanie regionów łańcucha polipeptydowego. Najczęściej występującym pofałdowaniem jest α helisa i struktura β. Struktura III-rzędowa z kolei dotyczy przestrzennego ułożenia aminokwasów, zarówno odległych w sekwencji liniowej jak i tych, które ze sobą sąsiadują. Struktura IV-rzędowa dotyczy białek, które posiadają więcej niż jeden łańcuch polipeptydowy (np. hemoglobina). Jest to najwyższy poziom organizacji białka. Struktura IV-rzędowa dotyczy przestrzennego ułożenia polipeptydowych podjednostek, a także oddziaływań między nimi, którymi mogą być m.in. wiązania kowalencyjne bądź oddziaływania niekowalencyjne [2], [3].
Z wykorzystaniem krystalografii rentgenowskiej możliwe jest zanalizowanie struktury drugo- i trzeciorzędowej białka. W technice tej promienie X kierowane są na kryształ danego białka oraz na jedną z jego pochodnych, która dodatkowo zawiera jon metalu ciężkiego. Wtedy to, emitowane promienie ulegają rozproszeniu w sposób, który jest zależny od gęstości elektronów w różnych częściach cząsteczki białkowej. Uzyskane na błonie fotograficznej zbiory plamek dyfrakcyjnych (po wywołaniu błony), są następnie tłumaczone na tzw. mapy rozkładu gęstości elektronowej. Po nałożeniu takiej mapy na drugą przez krystalografa, pozwala na skonstruowanie wiarygodnego modelu danego (badanego) białka [3].
Krystalografia rentgenograficzna pomimo, iż jest metodą drogą a dodatkowo czasochłonną, pozwoliła na ujawnienie szczegółowych i co najważniejsze precyzyjnych obrazów, usytuowania wszystkich aminokwasów w wielu białkach [3].
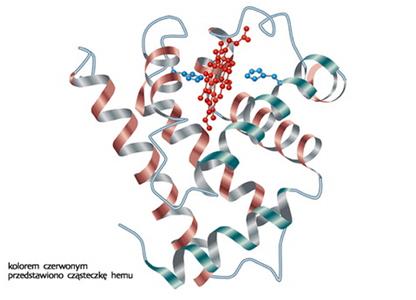
Zdjęcie: białka, struktura trzeciorzędowa mioglobiny,
Fot.: http://netsprint.encyklopedia.pwn.pl/haslo.php?id=1584337 [7].
Do zbadania czwartorzędowej struktury białek bardzo często stosuje się metody fizyczne, które opierają się na określeniu liczy i rodzaju obecnych w białkach protomerów, a także położenia względem siebie oraz oddziaływań między nimi zachodzących [3].
W składzie pierwiastkowym białek wyróżnia się ok. 50-55% węgla, 6,6-7,3% wodoru, 15-19% azotu oraz 19-21% tlenu. W zależności od budowy cząsteczkowej białek, różnią się one znacznie właściwościami fizycznymi, chemicznymi a także biologicznymi [4].
Masa cząsteczkowa białek waha się w granicach od 10 000 do wielokrotności miliona, co zależy od rodzaju białka , jego składu a także występowania. Ponadto białka mogą przyjmować różne kształty: od kulistych aż do formy włókienkowej, co też wiąże się z tym, że cechuje je nietrwałość budowy oraz bardzo duża wrażliwość na czynniki fizyczne i chemiczne. Tak więc, możliwe jest rozłożenie cząsteczki białka do aminokwasów, w wyniku zastosowania np. hydrolizy (kwasowej, zasadowej lub enzymatycznej) [4].
Białka dzieli się na białka proste, zbudowane tylko z aminokwasów, oraz na białka złożone, które dodatkowo zawierają nieaminokwasowe. Wśród związków nieaminokwasowych w budowie białek wyróżnia się hem, pochodne witamin czy lipidy [3].
Białka pełnią bardzo ważną rolę zarówno w budowie jak i w czynności komórki, w związku z czym bardzo szeroko stosuje się analizę niektórych białek w diagnostyce różnych chorób. Ze względu na różne właściwości i charakterystyczne cechy danego białka, stosuje się podział białek np. na podstawie ich rozpuszczalności, kształtu, czy właściwości chemicznej [3].
W celu izolacji określonych białek należy dobrać odpowiedni materiał, z których będą one pozyskiwane. Tak wiec, najkorzystniejszym źródłem białka jest materiał, który zawiera jak najwięcej izolowanego białka, które da się otrzymać w formie stabilnej w roztworze. Ponadto, dany materiał powinien być tani by nie ponosić dodatkowych kosztów i ubogi w zanieczyszczenia, co drastycznie skraca całą procedurę izolacji i oczyszczania białek [5].
Coraz bardziej znaną metoda uzyskiwania pożądanych białek, jest ich namnażanie(produkcja) w komórkach bakteryjnych, drożdżowych czy w hodowlach komórek ssaczych. Tak otrzymywane białka określane są mianem białek rekombinowanych. Główna zaletą tej drogi otrzymywania białek jest możliwość otrzymywania ich bardzo dużej ilości [5].
W celu izolacji białek wykorzystuje się określone metody, które pozwalają na wyodrębnienie danego białka z komórki (z dużą wydajnością), a jednocześnie na zachowanie jego charakterystycznych właściwości. Tak więc stosowane metody izolacji białek muszą zachowywać ich aktywność enzymatyczną, czy strukturę. Pleśnie, drożdże oraz komórki roślinne posiadają ścianę komórkową, która jest dodatkowym utrudnieniem podczas izolacji białek. Ściana jest odporna na lizę, przez co uniemożliwia izolację nie tylko białek, lecz także innych składników komórkowych [7].
W trakcie izolacji białek wykorzystuje się typowa procedurę, na którą składają się następujące etapy:
1) Przemycie masy komórkowej (z której ma być izolowane białko) w celu usunięcia pozostałości pożywki lub innych komórek – np. krwi (w przypadku tkanek)
2) Liza komórek
3) Oddzielenie frakcji komórkowych od siebie (tj. rozdział frakcji błon komórkowych, białek rozpuszczalnych oraz frakcji nierozpuszczalnej) [7].
Pod względem wydajności jednym z najważniejszych punktów całej izolacji jest etap dezintegracji komórek, przeprowadzany kilkoma różnymi metodami [7].
Homogenizacja [1], [7].
Homogenizacja jest jedną z najczęściej stosowanych metod dezintegracji miękkich tkanek zwierzęcych. Przeprowadza się ją w różnych typach homogenizatorów, w zależności od tkanki. Cały proces homogenizacji przebiega w obniżonej temperaturze ( od 0-4˚C), wraz z dodatkiem inhibitorów proteaz komórkowych. Inną metodą jest bonifikacja- stosowana do dezintegracji bakterii np. Escherichia coli, oraz komórek zwierzęcych np. mózgu. Sonifikacja wykorzystuje fale kawitacji wywołane w roztworze przez ultradźwięki, w wyniku czego dochodzi do mechanicznego uszkodzenia uszkodzenia ściany komórkowej. Jedną z głównych wad tej metody jest to, że ilość użytych komórek nie może przekraczać ok. 1 g na cykl, konieczne jest także chłodzenie zawiesiny komórek w trakcie wykonywania sonifikacji [1], [7].
Równie często stosowane jest ucieranie komórek z substancjami ściernymi, najczęściej wykorzystywane do rozbijania komórek organizmów jednokomórkowych. Jest to metoda mało kosztowna, wymagająca do użycia prostego sprzętu i tanich odczynników (tj. moździerza, piasku lub obojętnego tlenku glinu). Dodatkowo metoda pozwala na dezintegrację nawet 30 g na cykl. Ulepszeniem metody ucierania jest dezintegracja z kulkami szklanymi, które powodują uszkodzenia ściany komórkowej podczas wytrząsania. Najczęściej stosowana jest również do organizmów jednokomórkowych- w tym dla drożdży. Z wykorzystaniem enzymów trawiennych możliwa jest degradacja składników ściany komórkowej, w wyniku czego otrzymuje się komórki pozbawione ściany tj. tzw. protoplasty. Jeżeli pracujemy na bakteriach używa się lizozymu, który trawi bakteryjne peptydoglikany, z kolei dla drożdży wykorzystywana jest zymolaza (glukanaza), tj. enzym trawiący glukan- główny składnik ściany komórkowej drożdży [7].
W przypadku komórek będących w hodowli tkankowej często stosowaną metodą jest liza detergentami, gdy używa się niewysokich stężeń detergentów, wtedy liza zachodzi bardzo zachowawczo w stosunku do właściwości izolowanych białek. Wśród najczęściej stosowanych detergentów wyróżnia się m.in. Triton X-100 NP-40, dodecylan sodowy, siarczan sarkozylu i inne. Ponadto niekiedy stosuje się lizę za pośrednictwem rozpuszczalników organicznych. Jednakże metoda ta jest ograniczona do lizy komórek bakterii na sączkach, które następnie mają być inkubowane z przeciwciałami lub z sondami DNA [1],[7].
Do lizy czerwonych komórek krwi tj. erytrocytów bądź protoplastów (tj. komórek pozbawionych ściany komórkowej) używa się z kolei szoku osmotycznego. Komórki są wrażliwe na szok osmotyczny, kiedy przetrzymywane są w roztworach hipotonicznych, czyli takich, których ciśnienie osmotyczne jest mniejsze niż w cytoplazmie. Niektórzy stosują także zamrażanie i następnie rozmrażanie komórek, ponieważ wzrost objętości zamarzającej Woy- znajdującej się w cytoplazmie (a także powstające w wyniku zamrażania kryształy lodu), powodują uszkodzenia ściany i błony komórkowej. Wadą metody jest konieczność ochrony białek przed uwolnionymi głównie z lizosomów enzymami proteolitycznymi [1],[7].
W wyniku działania na komórki określonych detergentów dochodzi do uszkodzenia podwójnej warstwy lipidowej, czego skutkiem jest uwolnienie do roztworu białek błonowych. Peryferyjne białka błonowe mogą być usunięte na skutek dezintegracji dwuwarstwy lipidowej. Dokonać tego można przez przemywanie błon roztworem, charakteryzującym się dużą siłą jonową (np. 1 M NaCl o wysokim pH). Dzięki temu na skutek zerwania oddziaływań jonowych i wodorowych białka peryferyjne przytrzymywane są na powierzchni błony [1].
Izolacja białek komórkowych [10].
W przypadku, gdy dysponujemy zamrożonymi komórek, przed przystąpieniem do izolacji z nich białek komórkowych należy poddać je rozmrożeniu na lodzie, po wcześniejszym dwukrotnym przepłukaniu osadu roztworem PBS. Rozmrożony osad należy następnie zawiesić w roztworze Laemmli’ego (tj. 4% SDS, 20% glicerol, 120 mM Tris-HCl o pH=6,4). Kolejnym etapem jest poddanie próbki konikowaniu 2x po 15 sekund, po czym próbkę należy zwirować (12000 obr./min, 5 minut). Tak przygotowaną próbkę należy przechowywać w -20˚C [10].
Precypitacja (strącanie) białek za pomocą acetonu [8].
Do strącenia białek za pomocą acetonu należy używać zawsze określoną ilość lizatów komórkowych ( np. 50μg białka lub odpowiadającą mu ilość komórek w buforze do lizy komórek), po czym należy dodać co najmniej 5 objętości zimnego acetonu. Próbki z acetonem poddaje się inkubacji w -20˚C przez 30 minut, co 5 minut odwracając probówki. Po czasie inkubacji próbki wiruje się (15000 obr./minutę, 5 minut, 4˚C). Powstały po wirowaniu supernatant odrzucamy, a probówki pozostawia się do wyschnięcia (ok. 1 minuty). Wytrącone białko (biały osad) zawiesza się w buforze SB (tj. 1,51 g Trizma, 20 ml glicerol, 35 ml dH2O, po zmieszaniu roztwór należy doprowadzić za pomocą HCl do pH=6,8, a następnie dodać do niego 4 g SDS, 10 ml β-merkaptoetanolu oraz 0,002 g bromofenolu blue, a na koniec dopełnić roztwór do 200 ml i przechowywać w -20˚C), po czym inkubuje się probówki w 100˚C przez 5 minut. W celu przechowywania próbki należy umieścić w -20˚C [8].
Izolacja białek komórkowych- lizaty komórkowe [9].
Komórki z których ma być izolowane białko należy zwirować w temperaturze pokojowej (1400 x rpm, 5 minut), po czym przepłukać otrzymany osad komórek 2 razy za pomocą zimnego PBS. Po płukaniu PBS delikatnie się usuwa znad osadu, a dalej dodaje się zimny bufor lizujący, który zwiera świeżo dodane inhibitory proteaz (bufor lizujący tj.: 1ml NP40, 15 ml 1M Na, 4 ml 500 mM Tris-HCl o pH=7.4, 5 ml 100 mM NaF, 5 ml 100 mM NaPP, 5 ml 100 mM EDTA, 5 ml 100 mM EGTA, przyg. bufor należy przechowywać w 4˚C a przed użyciem należy dodać do niego świeże inhibitory proteaz i fosfotaz ). Należy stosować następujący przelicznik : 1 ml buforu/ 10 x 1 000 000 komórek rosnących w zawiesinie. Po dodaniu buforu lizującego komórki poddaje się inkubacji na lodzie przez 30 minut, komórki należy mieszać co 5 minut. Następnie, lizaty komórkowe wiruje się (10 000 x rpm, 5 minut, 4˚C) co ma na celu usunięcie niezlizowanych komórek i jąder komórkowych. Otrzymany nasącz przenosi się do nowych probówek, a na końcu oznacza się w nim zawartość wyizolowanego białka [9].
Dializa [5].
Jest metoda usunięcia z wodnego roztworu wszelkich związków drobnocząsteczkowych w tym np. soli, aminokwasów czy nukleotydów. Dializa jest metodą opcjonalną oczyszczania otrzymanych białek. Cały proces polega na przechodzeniu przez półprzeźroczystą błonę cząsteczek, których wielkość jest mniejsza niż pory w zastosowanej błonie. Tak więc cząsteczki mniejsze przechodzą do specjalnego roztworu znajdującego się na zewnątrz woreczka, z kolei cząsteczki większe są zatrzymywane w roztworze, ponieważ nie mogą one przejść przez pory błony. W związku z tym w woreczku zatrzymywane są cząsteczki białek bądź kwasów nukleinowych [5].
Przechodzenie przez błonę (np. błonę celulozową) trwa aż do momentu wyrównania stężenia danego związku drobnocząsteczkowego po obu stronach błony. Proces dializy można przyśpieszyć dzięki zastosowaniu stałego mieszania, bądź wymiany roztworu na zewnątrz woreczka dializacyjnego [5].
Wytrącanie białek z roztworu- wysalanie [6].
Wysalanie polega na wytrącaniu białek z roztworu za pomocą wysokich stężeń soli, procesowi temu ulegają białka rozpuszczalne w wodzie. W tym celu używa się soli, których jony łatwo tworzą wodziany, przy czym zjawisku temu sprzyjają aniony łatwo tworzące wiązania wodorowe lub charakteryzujące się dużą elektroujemnością. Zjawisko wysalania zachodzi, ponieważ sole wiążące wodę powodują pozbawienie białka płaszcza wodnego, dzięki czemu sprzyjają asocjacji białek w większe agregaty, co z kolei powoduje ich wypadanie z roztworu, ponieważ mają one zmniejszoną rozpuszczalność. Stężeni soli jakie jest potrzebne do wysolenia białek zależy od kilku czynników, w tym od właściwości samych białek, a także od pH środowiska [6].
Do wysalania zazwyczaj stosuje się takie sole jak m.in. Na2SO4 czy MgSO4. Należy zaznaczyć , że wysalanie białek jest procesem odwracalnym, tzn. że po usunięciu określonej soli z roztworu wytrącone białko ulega ponownemu rozpuszczeniu i wykazuje swoje biologiczne właściwości. Wysalanie stosowane jest do wstępnego frakcjonowania białek, również tych osocza, przy czym z osocza wytrąca się fibrynogen przy 25% nasyceniu siarczanem amonu, z kolie albuminy i globuliny wytrącają się przy dopiero 80% nasyceniu siarczanem amonu [6].
W celu przeprowadzenia wysalania białek osocza, należy odmierzyć do 2 probówek po 2,1 ml osocza, wcześniej rozcieńczonego 5x płynem fizjologicznym. Do pierwszej probówki dodać 0,7 ml nasyconego roztworu (NH4)2SO4 do końcowego nasycenia równego 25%, z kolei do drugiej probówki 2,1 ml nasyconego roztworu (NH4)2SO4 do końcowego nasycenia równego 50%. Następnie, zawartość probówek dokładnie wymieszać, wytrącony osad (białko) odwirować ( 3000 obr./minutę, 10 minut), otrzymany po wirowaniu nadsącz zdekantować, z kolei do osadu białek dodawać wodę destylowaną, aż do momentu rozpuszczenia osadu [6].
Autor: Lidia Koperwas
Literatura:
[1]. Rosiński M, Piasecka-Kwiatkowska D, Warchalewski J.R., 2005. Przegląd metod separacji i oczyszczania białek przydatnych w badaniach i analizie żywności, ŻYWNŚĆ. Nauka. Technologia. Jakość, 2005, 3 (44), 5 – 22.
[2]. Hames D.B., Hooper N.M., 2009. Biochemia-krótkie wykłady. Wydawnictwo Naukowe PWN, s. 33-34, 36-40
[3].Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W., 1995. Biochemia Harpera, Wydanie III, Wydawnictwo Leakarskiw PZWL, s.59-60, 65-69]
[4].Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 232
[5]. Derlacz R.,Girstun A., Kowalska-Loth B i wsp., 2008. Podstawy Biochemii Dla Ochrony Środowiska. UW, Wydz. Biologii, Instytut Biochemii 2008. s. 1-6
[6].Własności fizykochemiczne białek, s.2, http://biochigen.slam.katowice.pl/praktikum/012.pdf
[7].http://www.pg.gda.pl/chem/Katedry/Leki/Dydaktyka/BiologiaKomorki/Porownanie_metod_dezintegracji_komorek.pdf
[7].http://netsprint.encyklopedia.pwn.pl/haslo.php?id=1584337
[8]. http://metlab.pl/Stracanie_%28precypitacja%29_bialek_acetonem._p83.html
[9]. http://metlab.pl/Izolacja_bialek_komorkowych_-_lizaty_komorkowe_p68.html]
[10]. [http://metlab.pl/Izolacja_bialek_komorkowych_%28wszystkie_bialka%29_p30.html]









Recenzje