- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Niezwykłe właściwości zwykłych polisacharydów - glikozaminoglikany i ich zastosowanie w medycynie, cz. I
 Glikozaminoglikany są cukrami powszechnie wystęującymi w organizmach roślinnych i zwierzęcy. Ze względu na swoje wielorakie właściwości znalazły szerokie zstosowanie, m.in w medycynie. Ponadto pełnią bardzo ważne funkcje biologiczne i fizjologiczne, co jeszcze bardziej podkreśla fakt, że są one niezwykłymi cząsteczkami.
Glikozaminoglikany są cukrami powszechnie wystęującymi w organizmach roślinnych i zwierzęcy. Ze względu na swoje wielorakie właściwości znalazły szerokie zstosowanie, m.in w medycynie. Ponadto pełnią bardzo ważne funkcje biologiczne i fizjologiczne, co jeszcze bardziej podkreśla fakt, że są one niezwykłymi cząsteczkami. Glikozaminoglikany (GAG) są rodzajem polisacharydów, które zbudowane są z powtarzających się jednostek . Występują one na powierzchni komórek oraz w zewnątrzkomórkowej substancji podstawowej organizmów zwierzęcych. Glikozaminoglukany zbudowane sa z powtarzających się jednostek dwucukrowych, w skład których wchodzi pochodna cukru. Pochodną tą jest albo glukozoamina albo galaktozoamina [9].
Ponadto, przynajmniej jeden z cukrów w powtarzającej się jednostce disacharydu ma ujemnie naładowaną grupę karboksylową bądź siarczanową. Podjednostki te w zależności od klasy glikanu, składają się z reszty N-acetylowanej heksozaminy (d-galaktozaminy lub D-glukozaminy) albo N-siarczanowanej D-glukozaminy oraz z reszty kwasu heksuronowego (D-glukuronowego lub L-iduronowego). W składzi epodjednostek można także wyróżnić galaktozę. Ponadto, w niektórych glikozaminoglikanach wykazano obecność reszt L-fukozy, D-mannozy, D-ksylozy i kwasu N-acetyloneuraminowego [4], [3].
Obecność znacznej liczby reszt siarczanowych i karboksylowych w disacharydowych podjednostkach, które to budują szkielet polisacharydowy GAG, nadaje łańcuchom glikozaminoglikanów charakter tzw. polianionów. Wśród znanych GAG, kwas hialuronowy wykazuje minimalną gęstość ładunku ujemnego, ponieważ zawiera tylko jedną grupę karboksylową w pojedynczym disacharydzie.Z kolei, maksymalną wartość ładunku ujemnego ma heparyna, która zawiera trzy grupy siarczanowe, a także jedną grupę karboksylową w każdej z podjednostek [4], [3].
Glikozaminoglikany (GAG) mają zdolność wiązania SO2 oraz tworzenia kompleksów z białkami (monomery proteoglikanów), które to łączą się z kwasem hialuronowym co daje makrocząsteczki proteoglikanów. Makrocząsteczki te wypełniają przestrzenie w istocie podstawowej, wiążą wodę, przybierając postać żelu. Istota podstawowa, dzięki swojej budowie, umożliwia krążenie płynu tkankowego (tj. przesączu osocza krwi), który to pełni funkcje odżywcze dla komórek tkanki łącznej właściwej i tkanki chrzęstnej [7].
Wśród najbardziej znanych glikozaminoglikanów wyróżnia się siarczan chondroityny , siarczan keratanu, heparynę, a także siarczan dermatanu i powszechnie znany kwas hialuronowy [10].
Kwas hialuronowy
Kwas hialuronowy po raz pierwszy został wyizolowany z ciałka szklistego oka bydła – przez co wywodzi się jego nazwa. W strukturze tego kwasu wyróżnia się podjednostkę dwucukru znanego jako kwas hialoburonowy. Jest on złożony z N-acetylo-D-glukozaminy oraz z kwasu D-glukoronowego. Obie jednostki połączone są ze sobą za pomocą wiązań glikozydowych [9].
Kwas hialuronowy to polimer zbudowany z monomerów tj. kwasu glukuronowego i acetyloglukozaminy. W istocie podstawowej przybiera formę włókienek o długości ok. 2,5 μm. Kwas ten występuje we wszystkich organizmach żywych w takiej samej formie: solihialuronianu sodu (w stawach), we wszystkich substancjach łącznych oraz wiąże wodę w naskórku. Z wiekiem ilość kwasu hialuronowego w tkankach maleje, co powoduje starzenie się skóry (najbardziej znany objaw to powstawanie zmarszczek). Ponadto, kwas ten występuje również w gałce ocznej i płynie łzowym, jest też jedną z niewielu stosowanych w medycynie substancji identycznych z tymi występującymi w organizmie [7].
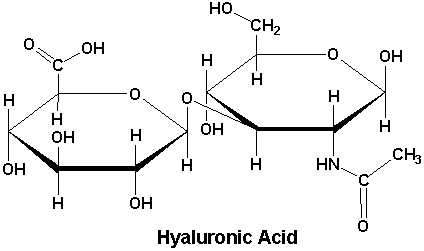
Ważną właściwością kwasu hialuronowego są jego naturalne właściwości żelujące. Jedna cząsteczka kwasu wiąże aż 250 cząsteczek wody, ponadto z racji tego, że kwas ten występuje w takiej samej postaci we wszystkich organizmach, otrzymywanie go jest bardzo łatwe. Kwas hialuronowy występuje w gałce ocznej w ciele szklistym, a także w płynie łzowym i cieczy wodnistej. W okulistyce stosowane są jego sole, określane mianem hialuronianów.
Hialuronian stosowany jest także w chirurgicznym leczeniu zaćmy, utrzymuje prawidłową głębokość przedniej komory oka oraz chroni rogówkę przed wysychaniem. W chirurgii rogówki tj. w przeszczepach, hialuronian tworzy wyściółkę dla nowej rogówki,dzięki czemu pozwala uniknąć formowania się zrostów, a także umożliwia skuteczniejsze zamknięcie się rany. Ponadto, wykorzystuje się go w leczeniu urazów oka, gdzie pomaga w przywróceniu poprzedniego ciśnienia oraz zapobiega zrostom [7].
Chondroityna
Jest glikozaminoglikanem, którego jednostką strukturalną jest dwucukier chondrozyna. Chondrozyna zbudowana jest z kwasu D-glukuronowego, który połączony jest glikozydowo z N-acetylogalaktozaminą. Łańcuch chondroityny (tj. 100-200 dwucukrów) powstaje w wyniku liniowej polimeryzacji chondrozyny wiązaniami glikozydowymi. Co ciekawe, chondroityna wystepuje jedynie w rogówce oka (nie stwierdzono jej obecności w innych tkankach) [9].
Siarczan dermatanu
Siarczan dermatanu zaliczany jest do wyjątkowych glikanów wśród polisacharydów siarkowych, a to ze względu na fakt, że zawiera rzadko spotykany izomer kwasu glukoronowego tj. kwas L-iduronowy. Ponadto, związek ten różni się od pozostałych siarczanów chondroityny tym, że posiada całkowitą odporność na działalność hialuronidazy rozkładającej oba pozostałe siarczany chondroityny [9].
Siarczan keratanu
Siarczan keratanu, dawniej znany jako keratosiarczan, wyróżnia się brakiem w cząsteczce kwasu uronowego. W jego strukturze wyróżnia się równe ilości D-galaktozy a także N-acetylo-6-O-sulfo-D-glukozaminy, które połączone są wiązaniami glikozydowymi. Siarczan keratanu występuje we wszystkich tkankach zwierzęcych , ponadto obok siarczanów chondroityny jest podstawowym składnikiem proteoglikanów. Największe ilości siarczanu keratanu odnotowuje się w rogówce oka, gdzie stanowi on ok. 50% całkowitej ilości GAG- to właśnie taki skład zapewnia rogówce przeźroczystość [9].
Heparyna jest glikanem, który po raz pierwszy został wyizolowany z wątroby bydlęcej w 1916 roku, w trakcie badań nad właściwościami przeciwkrzepliwymi tego nieznanego wówczas związku. Swoją nazwę zawdzięcza swojemu pochodzeniu. Heparyna powstaje w komórkach w komórkach tucznych, a także (częściowo) w śródbłonku pęcherzyków płucnych. Związek ten nigdy nie występuje w organizmie w postaci wolnej, lecz zawsze jest ona związana z białkami [9].
Biologiczna rola tego glikanu ujawnia się w przedłużeniu czasu krzepnięcia krwi u ssaków. Ponadto, inną równie ważną funkcją fizjologiczną jest aktywujący wpływ heparyny na system lipolityczny lipazy lipoproteinowej , która prawdopodobnie zawarta jest w śródbłonku naczyń włosowatych. Tym samym, związek ten ogrywa bardzo ważną funkcję w transporcie lipidów (co szczególnie ujawnia się w etiologii zmian miażdżycowych tętnic) [9].
Wynikiem polianionowego charakteru GAG jest udział tych związków w wewnątrzkomórkowych procesach transportowych oraz w ich powinowactwie do kationów. Konsekwencją powinowactwa GAG do kationów jest możliwość transportowania kationów i odkładania ich w tkankach. Z kolei, obecność polianionowych proteoglikanów (tj. związków zbudowanych z białkowego rdzenia, z którym związany jest jeden lub więcej łańcuchów GAG, jednego lub różnych typów) na powierzchni błon komórkowych leży u podstaw interakcji typu : komórka- komórka oraz komórka-substrat, co warunkuje procesy adhezji i migracji komórek [5], [3], [11].
Działanie heparyny opiera się na wzmacnianiu działania białkowego czynnika krzepnięcia tj. antytrombiny, dzięki czemu może ona przerywać kaskadę krzepnięcia na każdym etapie, realizowanym w osoczu (heparyna wiąże również wapń - kofaktor wielu białek uczestniczących w krzepnięciu osoczowym). Tak więc, wykazuje ona silne działanie in vivo i ex vivo po podaniu dożylnym (działanie natychmiastowe) lub podskórnym [8], [11].
Dzięki kompleksowemu i prawie natychmiastowemu działaniu po dożylnym podaniu, heparyna stosowana jest do leczenia wielu poważnych chorób i dolegliwości, a także w profilaktyce stanów chorobowych. Tak więc stosuje się ją przy wszystkich zaburzeniach procesów krzepnięcia i przy krwawieniach związanych z powstawaniem skrzepów wewnątrz naczyń krwionośnych. Ponadto, dzięki swojemu działaniu ex vivo (czyli w krwi poza układem krwionośnym), heparyna jest stosowana w zabiegach wymagających zastosowania tzw. krążenia pozaustrojowego [8], [11].
Heksozaminy są związkami, które w podwyższonej temperaturze oraz w środowisku zasadowym ulegaja degradacji. Z kolei, w obecności acetyloacetonu powstają chromogeny (głównie 2-metylopirol), które z kolei łatwiej ulegają kondensacji w środowisku kwasowym z aldehydem p-dimetyloaminobenzoezowym (tzw. ADAB), w wyniku czego powstaje barwny kompleks. Maksymalna absorpcja tego kompleksu przypada przy λ= 530 nm [2].
Wykonanie:
Całość dobrze wymieszać , zamknąć korkiem (najlepiej z chłodnicą zwrotną) i wstawić do łaźni wodnej o temp. 75C na 30 minut. W czasie inkubacji wytwarza się trwały chromogen . Po czasie inkubacji, próbki należy ochłodzić do temperatury pokojowej i oznaczyć w nich absorbancję przy λ = 530 nm. W sposób analogiczny postąpić z próbami wzorcowymi o stężeniu 50, 100, 200 µg/ml. Z wykreślonej krzywej kalibracyjnej odczytać stężenie badanych heksozamin (próba badana) [2].
Ilościowe oznaczanie N-acetylowanej heksozaminy (J.Reissig i wsp., 1995)
Wykonanie:
Po upływie inkubacji, próbki należy natychmiast schłodzić w wodzie z lodem, a dalej dodać do nic 3 ml roboczego roztworu ADAB (tj. rozpuścić 10 g ADAB cz.d.a. w 100 ml lodowatego kwasu octowego (CH3COOH) zawierającego 12,5% HCl- roztwór podstawowy, z kolei roztwór roboczy ADAB otrzymuje się przez zmieszanie 1 objętości roztworu podstawowego z 9 objętościami lodowatego kwasu octowego- wykonuje się to bezpośrednio przed użyciem) [1].
Następnie, probówki zamknąć korkami i wstawić do łaźni wodnej o temperaturze 38C na 20 minut. W tym czasie następuje rozwój chromogenu, którego absorbancję należy oznaczyć przy λ=545 nm wobec próby kontrolnej [1].
Autor: Lidia Koperwas
[1]. Reissig J.L., Strominger J.L., Leloir L., 1995. A modified colorimetric method for the estimation of N-acetylamino sugars. J. Biol. Chem., 217: 959-962.
[2]. Belcher B., Nutten A.J., Sambrook C.M., 1954. The determination of glucosamine. The Analyst, 79: 201-205.
[3]. Daroszewski J., Rybka J., Gamian A., 2006. Glycosaminoglycans in the pathogenesis and diagnostics of Graves’s ophthalmopathy. Postepy Hig Med Dosw. (online), 2006; 60: 370-378
[4]. Głowacki A., Koźma E. M., Olczyk K., Kucharz E.J.: Glikozoaminoglikany - struktura i funkcja. Post. Biochem.,1995;41,139-148 [PubMed]
[5]. Koźma E.M., Głowacki A., Olczyk K., Jaźwiec M.: Proteoglikany - struktura i funkcja. Post. Biochem.,1997;43,158-172 [PubMed]
[6]. Żak I, Węglowodany , http://biochigen.slam.katowice.pl/podrecznik/10.pdf]
[7]. Dr n med. Krzemińska S. Kwas hialuronowy w medycynie, Farmakoterapia. http://www.wydawnictwoapteka.pl/files/UserFiles/file/SF_07-08_2010/8-10%20kwas%20hialuronowy.pdf
[8]. http://www.neutralizacja-heparyny.pl/cele/heparyna
[9]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 283-288.
[10]. Stryer L., 2003. Biochemi, Wydanie czwarte, s. 506-507. PWN 2003.
[11]. Liu J., Thorp S. C.: Cell surface heparan sulfate and its roles in assisting viral infections. Med. Res. Rev. 2002, (22, 1-25)









Recenzje