- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Reakcje wykorzystywane do wykrywania wybranych aminokwasów i białek
 Aminokwasy zaliczane są do najpopularniejszych związków naturalnych, a to ze względu na ich obecność we wszystkich białkach. Ponadto, związki te wchodzą w skład innych związków biologicznie czynnych, w tym np. neuroprzekaźników oraz alkaloidów. W syntezie białek wykorzystywanych jest jedynie 23 aminokwasy- są to tzw. aminokwasy kodowane, tj. takie, które są rozpoznawane przez kod genetyczny. Znanych jest kilka rodzajów aminokwasów, w tym np. aminokwasy aromatyczne. Co ważne, w zależności od składu pierwiastkowego oraz od budowy, różne aminokwasy ulegają różnym reakcjom, dzięki czemu możliwe jest ich łatwe wykrywanie i różnicowanie [3].
Aminokwasy zaliczane są do najpopularniejszych związków naturalnych, a to ze względu na ich obecność we wszystkich białkach. Ponadto, związki te wchodzą w skład innych związków biologicznie czynnych, w tym np. neuroprzekaźników oraz alkaloidów. W syntezie białek wykorzystywanych jest jedynie 23 aminokwasy- są to tzw. aminokwasy kodowane, tj. takie, które są rozpoznawane przez kod genetyczny. Znanych jest kilka rodzajów aminokwasów, w tym np. aminokwasy aromatyczne. Co ważne, w zależności od składu pierwiastkowego oraz od budowy, różne aminokwasy ulegają różnym reakcjom, dzięki czemu możliwe jest ich łatwe wykrywanie i różnicowanie [3].Słowa kluczowe: aminokwasy, białka, denaturacja, koagulacja, aminokwasy siarkowe, aminokwasy aromatyczne, próba ksantoproteinowa, grupa tiolowa.
Metody analizy, identyfikacji , a także oczyszczania i biofizycznej charakterystyki białek ewoluowały wraz z rozwojem wiedzy na ich temat, a także z pojawieniem się nowych celów badawczych, w których zakładano wykorzystanie tych specyficznych cząsteczek.
Pod wpływem działania podwyższonej temperatury, białka mogą ulec nieodwracalnej denaturacji. Dochodzi wówczas do zmiany struktury białek, w wyniku czego stają się one nieaktywne biologicznie. Zjawisko to zachodzi w wyniku utraty trzeciorzędowej lub czwartorzędowej struktury, jednak dochodzi do tego powyżej pewnej temperatury. Ponadto, denaturację białek mogą wywoływać sole metali ciężkich, mocne kwasy i zasady, a także niskocząsteczkowe alkohole, aldehydy oraz napromieniowanie. Biała proste stanowią pewien wyjątek, a to dlatego, że mogą one ulec procesowi odwrotnemu do denaturacji tj. denaturacji, jednak tylko wtedy kiedy zostanie usunięty czynnik denaturujący.
Niektóre białka pod wpływem zwiększonego stężenia soli w roztworze, mogą ulec nieodwracalnej denaturacji, jednakże proces wysalania białek w większości przypadków jest całkowicie odwracalny. Tak więc, zjawisko wysalania może być z powodzeniem wykorzystywane do izolowania lub rozdzielania białek, jednak przy większych stężeniach soli może dojść do uszkodzenia otoczki solwatacyjnej [4].
Pod wpływem ciepła dochodzi do zrywania w cząsteczkach wiązań wodorowych, co w konsekwencji prowadzi do nieodwracalnej denaturacji białek. Cały proces denaturacji zależy od rodzaju białka, na który działa określona temperatura, zazwyczaj denaturacja rozpoczyna się w przedziale 40˚C-100˚C. Niektóre białka wytrzymują krótkie gotowanie, wśród nich jest żelatyna, rybonukleaza. Białko, które jest denaturowane w punkcie izoelektrycznym jest nierozpuszczalne [2].
Cieplna denaturacja i koagulacja białka
Do probówek należy odmierzyć po 2 ml 1% roztworu białka (jaja kurzego), a następnie dodać:
- 0,2 ml 0,01M roztworu HCl (o pH=3)- do pierwszej probówki
- 0,2 ml buforu octanowego (o pH=4,7)- do drugiej probówki
- 0,2 ml 0,01M roztworu NaOH (pH=11)- do trzeciej probówki
Wszystkie probówki wstawić do wrzącej łaźni wodnej na ok. 15 minut, po inkubacji próbki oziębić . Następnie, do probówek nr 1 i 3 dodać po 2 ml 0,01 M buforu octanowego ( o pH=4,7). W próbkach tych powinna wytrącić się denaturowana albumina, z kolei w probówce nr 2 pojawia się osad, który jest denaturowaną i skoagulowaną albuminą [2].
Reakcja Libermanna
Reakcją charakterystyczną (służącą do identyfikacji) glikoprotein jest tzw. reakcja Libermanna. W trakcie jej przebiegu, podczas ogrzewania ze stężonym roztworem HCl dochodzi do hydrolizy białka, zaś z cukrów (jednocześnie) powstają pochodne furfuralowe. Te z kolei, z uwolnionymi w czasie hydrolizy fenolami, dają fioletowo zabarwione połączenia.
Wykonanie:
Do 1 ml surowicy (2x rozcieńczonej 0,9% roztworem NaCl) należy dodać 3 ml stężonego HCl, próbkę ogrzewać przez kilka minut.
Wyniki: W trakcie ogrzewania roztwór stopniowo zabarwia się na kolor fioletowy [2].
Wykrywanie siarki cystyny i cysteiny w aminokwasach
Aminokwasy, które w swojej budowie zawierają grupy siarkowe –SH lub –S-S- występujące w stanie wolnym lub związanym w białkach (tzw. aminokwasy siarkowe),podczas ogrzewania w środowisku silnie alkalicznym, ulegają przekształceniu do kwasu pirogronowego. Wtedy też dochodzi do uwolnienia siarki w postaci jonów siarczkowych. Następnie, jony te reagują z jonami ołowiu (II), w wyniku czego powstaje czarny osad.(PbS). Dodatkowym produktem powstającym w czasie tej reakcji jest amoniak. Należy zaznaczyć, że metionina nie daje dodatniego wyniku tej reakcji [6].
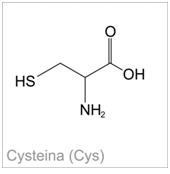
Zdjęcie: Cysteina, http://portalwiedzy.onet.pl/80958,1,,,cysteina_wzor_strukturalny,haslo.html
Reakcja cystynowa:
W trakcie ogrzewania białek z ługiem dochodzi do ich hydrolizy, zaś zawarta w cystynie i cysteinie siarka ulega uwolnieniu w postaci jonów siarczkowych, które to z jonami Pb2+ dają czarny osad PbS. Metionina (inny aminokwas siarkowy) nie daje dodatniego wyniku przedstawionej reakcji [2].
1) Do 1 ml surowicy (rozcieńczonej 10 x za pomocą 0,9% roztworu NaCl) należy dodać kilka kropli 1% roztworu (CH3COO)2Pb, a także 2 ml 30% roztworu NaOH. Próbkę wstawić do wrzącej łaźni wodnej.
Wyniki: Po kilkunastu minutach gotowania pojawia się czarny osad [2].
2) Do 3 probówek należy kolejno odmierzyć po 0,5 ml :
- 1% roztworu cystyny lub cysteiny- do pierwszej probówki
- 1% roztworu metioniny – do drugiej probówki
- 1% roztworu białka jaja kurzego, albuminy, żelatyny, lub rozcieńczonej 10x surowicy- do trzeciej probówki
Następnie, do wszystkich probówek dodać po 1 kropli 0,25M roztworu octanu ołowiu (II). Próbki wymieszać, po czym dodać do nich 2 ml 20% roztworu NaOH. Wymieszane próbki wstawić do wrzącej łaźni wodnej na 2-3 minuty. Po tym czasie porównać i zinterpretować wyniki ( jak wyżej) [6].
Cystyna podczas ogrzewania w stężonym roztworze NaOH, ulega częściowej mineralizacji, tj. rozkładowi do związków nieorganicznych. Wolne jony S2-, które są obecne w mieszaninie poreakcyjnej, reagują z jonami Pb2+ , w wyniku czego powstaje czarny osad (siarczek ołowiu)
Do 1 cm3 roztworu cysteiny należy dodać 2 cm3 20% NaOH, po czym próbkę ogrzewać we wrzącej łaźni wodnej przez 10 minut. Po inkubacji, do próbki dodać kilka kropli 2% Pb(CH3COO)2, po czym próbkę ponownie ogrzewać. W trakcie ogrzewania pojawia się czarny osad [5].
Reakcja z nitroprusydkiem sodu- wykrywanie grup tiolowych w cysteinie
Związki, które zawierają w swej budowie ugrupowania tiolowe, tj. SH, w reakcji z nitroprusydkiem sodu tworzą kompleksowe połączenia, o czerwono-fiołkowym zabarwieniu.
Do 1 cm3 roztworu cysteiny należy dodać 1 cm3 1% roztworu nitroprusydku sodu. Próbkę nasycić siarczanem amonu in substantia , po czym próbkę zalkalizować za pomocą amoniaku. W wyniku zachodzących reakcji pojawia się czerwono-fiołkowe zabarwienie świadczące o obecności grup tiolowych w próbce [5].
Próba ksantoproteinowa- wykrywanie ugrupowania aromatycznego w aminokwasach aromatycznych
Aminokwasy aromatyczne, do których zalicza się fenyloalaninę, tyrozynę i tryptofan, występujące zarówno w formie wolnej jak i związanej w białku, pod wpływem stężonego kwasu HNO3 (reakcja nitrowania), tworzą nitrowe pochodne o barwie żółtej. Dodatek NaOH powoduje pogłębienie barwy do pomarańczowej (skutkiem utworzenia odpowiedniej soli w wyniku zachodzącej reakcji) [6], [5].
Sporadycznie można nitować związki aromatyczne za pomocą stężonego kwasu azotowego (V). Reakcja ta udaje się np. w przypadku związków posiadających skondensowane pierścienie (np. antracen), a także w przypadku tyrozyny i tryptofanu. W reakcjach nitrowania innych związków aromatycznych (także fenyloalaniny), do najczęściej wykorzystywanych azotowych elektrofilów zalicza się kation nitroniowy (NO2+). Jon ten powstaje z kwasu azotowego (V) pod wpływem katalizującego protonu , który dostarczany jest przez kwas siarkowy. W wyniku reakcji uprotonowany kwas azotowy (po odłączeniu cząsteczki wody), przechodzi w postać jonu nitroniowego. W praktyce, w celu przeprowadzenia reakcji nitrowania stosuje się tzw. mieszaninę nitrującą, w której skład wchodzi stężony kwas azotowy (V) i stężony kwas siarkowy (zmieszane w stosunku 1:3 v/v) [6].
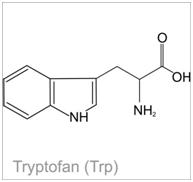
Zdjęcie: Tryptofan, http://portalwiedzy.onet.pl/81707,1,,,tryptofan_wzor_strukturalny,haslo.html
Wykonanie próby ksantoproteinowej:
1). Należy przygotować trzy probówki, po czym odmierzyć do nich po 1 ml:
– 1% roztworu tyrozyny – do pierwszej probówki,
– 1% roztworu glicyny – do drugiej probówki,
– 1% roztworu białka (albuminy, owoalbuminy lub żelatyny albo rozcieńczonej surowicy)- do trzeciej probówki.
Następnie, do wszystkich probówek należy dodać po 1 ml stężonego kwasu azotowego (V), próbki ogrzewać przez 5 minut we wrzącej łaźni wodnej. Po tym czasie zaobserwować, w których probówkach roztwór zabarwił się na kolor żółty. Następnie wszystkie probówki należy oziębić pod bieżącą wodą i dodać do nich po 4 ml 20% roztworu NaOH (jest to reakcja silnie egzotermiczna!).
W ostatnim etapie doświadczenia, zaobserwować, w których probówkach roztwór zabarwi się na kolor żółto-pomarańczowy [6].
2). Do 1 cm3 roztworu aminokwasu aromatycznego należy dodać 0,5 cm3 stężonego kwasu HNO3. Próbkę ogrzewać we wrzącej łaźni wodnej przez 10 minut. Zaobserwować pojawienie się żółtego zabarwienia. Następnie, po oziębieniu próbki dodać do niej 4 cm3 20% NaOH, wtedy to barwa roztworu staje się bardziej intensywna [5].
Histydyna
Histydyna jest aminokwasem, który posiada bardzo duże powinowactwo do tlenu singletowego. Ponadto, ma ona zdolność wiązania się z jonami metali przejściowych m.in. z miedzią , cynkiem, niklem czy żelazem, gdzie w takich połączeniach aminokwas ten stanowi kluczowy pod względem czynnościowym składnik białek (o właściwościach enzymatycznych). W mięśniach i mózgu ssaków występują wysokie (milimolowe) stężenia dipeptydów, których jednym ze składników jest histydyna (np. an seryna czy karnozyna). Dipeptydy te mają właściwości antyoksydacyjne, co wynika między innymi z ich zdolności do wiązania jonów miedzi [1].
Przeprowadzone badania doświadczalne ujawniły, że histydyna jest aminokwasem, który zapobiega rozwojowi dysfunkcji skurczowej oraz uszkodzeniom ultrastrukturalnym. Ponadto, histydyna wykazuje właściwości antyarytmiczne. Tak więc, ze względu na właściwości kardioprotekcyjne, histydyna znalazła zastosowanie jako składnik niektórych płynów kardioplegicznych (płyny podawane pod ciśnieniem do aorty) [1].
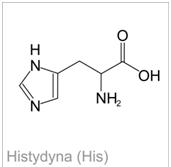
Zdjęcie: Wzór histydyny, http://portalwiedzy.onet.pl/81789,1,,,histydyna_wzor_strukturalny,haslo.html
Reakcja (próba) Pauly’ego- wykrywanie pierścienia imidazolowego w histydynie [5], [6].
W środowisku zasadowym pierścień imidazolowy obecny w histydynie, ulega reakcji sprzęgania z jonem p-sulfobenzenodiazioniowym.
Wyniki: Produktem tej reakcji jest pomarańczowy barwnik, tzw. barwnik azowy [5], [6].
Wykonanie:
1) Należy przygotować 3 probówki, do każdej odmierzyć po 0,5 ml:
- 0,5% roztworu histydyny- do pierwszej probówki
- 1% roztworu glicyny- do drugiej probówki
- 1% roztworu białka np. jaja kurzego, albuminy lub żelatyny- do trzeciej probówki.
Otrzymywanie roztworu soli diazoniowej:
Do probówki odmierzyć 5 ml 0,5% roztworu kwasu sulfanilowego. Probówkę umieścić w zlewce z zimną wodą, po czym do próby dodać 0,5ml 0,5% roztworu NaNO2, całość dokładnie wymieszać. Otrzymany roztwór zalkalizować, za pomocą roztworu Na2CO3 in subst.- odczyn (pH) mieszaniny sprawdzić za pomocą papierka wskaźnikowego.
Następnie, do przygotowanych wcześniej 3 probówek ( z przygotowanymi roztworami aminokwasów lub białka), należy oddać zalkalizowany roztwór soli diazoniowej, całość wymieszać.
Wyniki: Pojawienie się w próbówce pomarańczowego zabarwienia świadczy o dodatnim wyniku próby na obecność histydyny [6].
2) Do 5 cm3 0,5% roztworu kwasu sulfanilowego należy dodać 0,5 cm3 0,5% roztworu NaNO2- chłodząc próbkę w zimnej wodzie. Powstały w ten sposób roztwór soli diazoniowej należy zalkalizować za pomocą roztworu Na2CO3 in substantia. Odczyn roztworu sprawdzić za pomocą papierka wskaźnikowego. Następnie, do probówki zawierającej 1 cm3 roztworu histydyny wlać roztwór soli diazionowej.
Wyniki: Powstaje pomarańczowo-czerwone zabarwienie (jak wyżej) [5].
Autor: Lidia Koperwas
Literatura:
[1]. Gawiński Ł., Wierzba T.H., 2006. Effect of histidine on heart rate variability in the rat. Ann. Acad. Med. Gedan., 2006, 36, 53-61.
[2]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 242-243, 246.
[3]. Kołodziejczyk A., 2006. Aminokwasy i peptydy, http://tczew.net.pl/~mgrmisiek/Technologia%20Chemiczna/A%20M%20I%20N%20O%20K%20W%20A%20S%20Y%20%20%20i%20%20%20P%20E%20P%20T%20Y%20D%20Y.pdf
[4].http://fundacjarozwojunauki.pl/res/Tom1/Nauka%20swiatowa%20i%20polska%5B1%5D.Rozdzial%2003.pdf
[5]. http://www.am.lublin.pl/upload/jednostkiam/Chemia%20Medyczna/aminokwasy.pdf
[6]. http://biochigen.slam.katowice.pl/praktikum/011.pdf









Recenzje