Wstęp
Izoprostany są to strukturalne izomery prostaglandyn. In vivo powstają one w wyniku wolnorodnikowej peroksydacji wielo- nienasyconych kwasów tłuszczowych. Izoprostany powszechnie występują w płynach biologicznych, takich jak mocz, krew, płyn mózgowo-rdzeniowy, a także w wydychanym powietrzu. Prowadzone są badania nad możliwościami wykorzystywania analizy ilościowej izoprostanów w diagnostyce ostrych stanów zapalnych i chorób degeneracyjnych będących następstwem stresu oksydacyjnego. Odkrycie izoprostanów stanowi postęp w badaniach dotyczących wpływu wolnych rodników na patogenezę ludzkich chorób [1].
Budowa i mechanizm powstawania izoprostanów
Integralną część błon biologicznych stanowią wielonienasycone kwasy tłuszczowe, takie jak kwas arachidono¬wy (AA). Związek ten bardzo łatwo ulega utlenieniu ze względu na obecność licznych wiązań podwójnych. Proces utlenienia kwasu arachidonowego (AA) może przebiegać na drodze enzymatycznej lub nieenzymatycznej. W wyniku enzymatycznej peroksydacji powstają lipidowe hormony tkankowe z grupy prostaglandyn, tromboksanów i leukotrienów.
Natomiast nieenzymatyczna peroksydacja kwasu arachi¬donowego (AA), związana z aktywnością reaktywnych form tlenu w warunkach stresu oksydacyjnego, prowadzi do powstania izoprostanów (IzoP). Proces ten jest niezależny od aktywności enzymatycznej cyklooksygenazy, enzymu katalizującego przemianę kwasu arachi¬donowego (AA) do prostaglandyn. Reaktywne formy tlenu (RFT) odrywają atom wodoru z wielonienasyconych kwasów tłuszczowych i propagują reakcję łańcuchową. Powoduje to powstanie trzech form rodnikowych, które następnie poddane procesowi wewnętrznej cyklizacji, poprzez redukcję wodorem form prostaglandynowych, prowadzą do utworzenia czterech regioizomerów posiadających pierścień typu F. Każdy z tych regioizomerów może wytworzyć osiem racemicznych diastereomerów. W tym procesie mogą powstać w różniących się ilościach 64 różne związki [1].
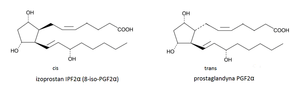
Izoprostany są stereoizomerami prosta¬glandyn. Posiadają one konfiguracje cis łańcuchów węglowodorowych przy pięcioczłonowym pierścieniu stanowią¬cym typowy motyw strukturalny cząsteczki, w odróżnieniu od konfigura¬cji trans występującej w cząsteczkach prostaglandyn (Rys.1) [2]
Rys.1. Stereoizomeria cis l trans w cząsteczkach izoprostanu i prostaglandyny.
Nomenklatura izoprostanów oparta jest na czterech typach izoprostanów, jako głównych przedstawicielach pochodnych związków wywodzących się z kwasu arachidonowego. Do określenia izoprostanów używa się skrótu „izoP”. Główne klasy izoprostanów zostały oznaczone literami D, E, F, G i H w celu podkreślenia typu cyklopentanowego pierścienia. Ilość podwójnych wiązań w łańcuchach bocznych oznacza się odpowiednią cyfrą 1, 2, 3 lub 4. Symbole a lub b są wykorzystane dla wykazania stereochemii dwóch grup OH w pierścieniu cyklopentanu. Przedrostek a oznacza obecność dwóch grup OH rzutowanych pod płaszczyzną cząsteczki, przedrostek b oznacza położenie grupy OH ponad płaszczyzną pierścienia cyklopentanu. W sytuacji, kiedy jedna grupa OH jest w położeniu a, a druga w b, oznaczenie a ma pierwszeństwo [2].
Powstawanie izoprostanów in vivo
Izoprostany powstają w fosfolipidach błon biologicznych lub lipoproteinach osocza krwi, gdzie występują zestryfikowane z glicerolem. Następnie są one uwalniane z cząsteczki natywnego fosfolipidu wskutek hydrolitycznej aktywności enzymatycznej odpowied¬nio fosfolipazy A2 w błonach lub acetylohydrolazy czynnika aktywującego płytki we krwi. Uwolnione izoprostany krążą we krwi i są wydalane z moczem [3].
Duże ilości izoprostanów mogą być wytwarzane in vitro tj. po pobraniu próbki, dlatego też zastanawiano się, czy ich oznaczenia przedstawiają rzeczywistą wartość endogennych związków, czy też są one formowane in vitro przez autooksydację lipidów osocza krwi. Możliwość ta wydaje się mało prawdopodobna, ponieważ osocze zawiera przeciwutleniacze hamujące peroksydacje lipidów do czasu całkowitego zużycia endogennego askorbinianu. Ponadto w krwi znajdującej się w strzykawkach zawierających syntetyczny przeciwutleniacz nie zaobserwowano obniżenia zawartości izoprostanów. Mocz zawiera nieznaczną ilość lipidów, dlatego też mało prawdopodobne jest, aby izoprostany były syntetyzowane in vitro. Ponadto ilość izoprostanów w moczu nie wzrasta po jego 5-dniowej inkubacji w temperaturze 37oC. Wykazano także, że stężenie IzoP-F2 w moczu było wyższe w porównaniu do stężenia IzoP-F2 w krwi zdrowych dawców [3].
Przeprowadzono badania w celu wykazania powstawania izoprostanów in vivo. Stwierdzono wzrost zawartości izoprostanów w osoczu krwi szczurów poddanych działaniu czterochlorku węgla (CCl4) lub herbicydu - parakwatu, dla wywołania oksydacyjnych uszkodzeń. Ilość izoprostanów wzrastała 200-krotnie w porównaniu do grupy kontrolnej zwierząt. Szybkość tworzenia się IzoP-F2 dodatnio korelowała z rozmiarem uszkodzeń wątroby. Fakt ten potwierdzano wzrostem aktywności aminotransferazy alaninowej (ALA) w osoczu krwi. Stężenie izoP-F2 osiągneły maksymalny poziom po 4 godzinach od podania czterochlorku węgla (CCl4). Natomiast aktywność aminotransferazy alaninowej (ALA) wzrosła wolniej i utrzymywała się przez 24 godziny. Ponadto w badaniach tych wykazano, że Izo-F2 tworzyły się w znacznie mniejszych ilościach u szczurów karmionych hepatotoksycznymi dawkami tioacetamidu lub paracetamolu, związkami, które nie są metabolizowane do form rodnikowych. Stwierdzono także, że po podaniu czterochlorku węgla (CCl4) szybciej wzrosło stężenie IzoP-F2 w formie zestryfikowanej z fosfolipidami wątroby niż wolnych IzoP we krwi. Sugeruje to, że IzoP-F2 są początkowo estryfikowane, a później powoli uwalniane do krążenia głównego [3].
Izoprostany - markery stresu oksydacyjnego
Początkowo izoprostany uważane były za nieaktywne biologicznie produkty peroksydacji lipidów, których poziom w komórkach i tkankach dodatnio korelował z poziomem wolnych rodników tlenowych katalizujących proces nieenzymatycznego utlenienia lipidów. Znaczenie izoprostanów w biologii i medycynie odkryto w 1990 roku [4].
Izoprostany są skutecznymi markerami oksydacyjnych uszkodzeń in vivo i in vitro, łatwymi w ilościowym i jakościowym oznaczaniu w płynach biologicznych. Izoprostany należą do wiarygodnych biomarkerów peroksydacji lipidów i stresu oksydacyjnego, ze względu na: stabilność i względną obfitość w płynach ustrojowych, specyficzność w stosunku do indukowanej wolnorodnikowej peroksydacji lipidów oraz syntezę in vivo. Ponadto, występują one w wykrywalnych ilościach, jako formy zestryfikowane w tkankach, a jako formy wolne w płynach ustrojowych. Pozwala to na określenie prawidłowego, fizjologicznego poziomu izoprostanów w organizmie. Nawet niewielki wzrost ich ilości może być wykryty w warunkach stresu oksydacyjnego [4].
Ilościowe oznaczenie izoprostanów dostarcza wiarygodnego i czułego wskaźnika przemian peroksydacyjnych lipidów in vivo, pozwalając na oszacowanie udziału wolnych rodników w patofizjologii wielu chorób. Podwyższoną zawartość izoprostanów w krwi i moczu zaobserwowano w kilku zespołach chorobowych związanych z nadmiernym wytwarzaniem wolnych rodników. Są to między innymi: choroby neurodegeneracyjne (Alzheimera, Huntingtona, Creutzfelda-Jakoba, stwardnienie rozsiane MS), alkoholowa choroba wątroby, uszkodzenia wywołane paleniem tytoniu, sklerodermia, hipercholesterolemia i miażdżyca, astma, zapalenia płuc oraz cukrzyca [5].
Szczególnie wrażliwy na oksydacyjne uszkodzenia jest mózg ze względu na wysokie zużycie tlenu oraz zwiększony poziom żelaza, które pełni rolę katalizatora. Ponadto w mózgu występują wielonienasycone kwasy tłuszczowe, które łatwo ulegają utlenianiu oraz występuje niski poziom enzymów antyoksydacyjnych. Pomimo tego, że reaktywne rodniki mogą uszkadzać DNA i białka komórkowe, to wysoka zawartość nienasyconych lipidów powoduje, że to ich peroksydacja jest podstawą oksydacyjnych uszkodzeń mózgu. Występowanie stresu oksydacyjnego i peroksydacji lipidów w mózgu może zostać wykryte dzięki możliwości oznaczania zawartości izoprostanów w płynie mózgowo-rdzeniowym. Ponadto stężenie izoprostanów może zostać oznaczone poprzez analizę osocza krwi, moczu i wydychanego powietrza [5].
Na szczególną uwagę zasługuje izoprostan 8-iso-PGF2α produkowany w dużej ilości in vivo. Związek ten jest obiektywnym wskaźnikiem poziomu całkowitego stresu oksydacyjnego w organizmie człowieka. Zaletą izoprostanu 8-iso-PGF2α jest bezpośrednia zależność od poziomu wolnych rodników tle¬nowych, co stanowi o wysokiej specyficzności metody diagnostycznej. Ponadto 8-iso-PGF2α charakteryzuje się znaczną stabilnością w materiale biologicznym, związaną z nasyconym charakterem pierścienia cyklopentanu, dzięki czemu jest zna¬komitym markerem diagnostycznym występującym w warunkach prawi¬dłowych i patologicznych. W tkankach znajduje się on głównie w formie zestryfikowanej, natomiast w płynach ustrojowych w formie wolnej. Po pobraniu materiału biologicznego do analizy niekontrolowana synteza izoprostanu 8-iso-PGF2α jest hamowana przez wysoki poziom naturalnych przeciwutleniaczy obecnych w krwi i innych płynach ustrojowych. Izoprostany charakteryzują się krótkim okresem półtrwania w krwi, wynoszącym około 16 minut i są usuwane z organizmu głównie przez płuca i nerki. Stąd stężenie izoprostanów w moczu bywa nawet wyższe niż we krwi. Wykazano, że zawartość 8-iso-PGF2α w moczu nie wzrasta nawet po 5-dniowej inkubacji próbki w temperaturze 37oC. Fakt ten sprawia, że analiza moczu jest chętnie stosowaną nieinwazyjna techniką badania poziomu stresu oksydacyjnego wykorzystywaną w licznych próbach klinicznych oceniających skuteczność i bezpieczeństwo stosowania leków hipotensyjnych, moczopędnych, przeciwmiażdżycowych i wielu innych. Poziom izoprostanów wyraża się w przeliczeniu na kreatyninę oznaczoną w moczu pacjenta ze względu na różną objętość dobową moczu [6].
W celu oznaczenia izoprostanów w materiale biologicznym wykorzystywane są różne metody analityczne, jak: wysokosprawna chromatografia cieczowa, chromatografia gazowa, spektrometria masowa oraz metody immunochemiczne oparte na technice ELISA z użyciem specyficznych przeciwciał dla 8-iso-PGF2α. Coraz większą popularnością cieszy się immunochemiczna metoda oznaczania izoprostanów w próbkach płynów ustrojowych. Do zalet tej metody należą niskie koszty, niewielkie wymagania sprzętowe oraz krótki czas wykonania analizy [7].
Przeprowadzono liczne badania, które pozwoliły na ustalenie warto¬ści referencyjnych poziomu izoprostanów w osoczu krwi ludzkiej oraz w moczu. Analiza poziomu izoprostanów jest wykorzystywana do monitorowania poziomu stresu oksydacyjnego i ewaluacji czynników ryzyka lub skuteczności terapii w prze¬biegu niektórych chorób, takich jak: miażdżyca tętnic, cukrzyca insulinozależna (typu I), cukrzyca insulinoniezalezna (typu II), otyłość, choroby neurodegeneracyjne, rzucawka i stan przedrzucawkowy, nikotynizm oraz niektóre stany patofizjologiczne [7].
Patofizjologiczna aktywność izoprostanów
Izoprostany odgrywają istotną rolę w patologii komórki. Związki te mogą powodować oksydacyjne uszkodzenia błony komórkowej lub błon organelli komórkowych. Cząsteczka izoprostanu wpływa na płynność i integralność błon fosfolipidowych poprzez zmianę oddziaływania międzycząsteczkowego. Zmiany te są powodowane przez rearanżację wiązań podwójnych i grup hydroksylowych w cząsteczce izoprostanu, która jest stabilizowana kowalencyjnie pięcioczłonowym pierścieniem [8].
Wykazano, że 8-iso-PGF2α stymuluje skurcz mięśni gładkich w ścianie naczyń krwionośnych mózgu, serca oraz nerek. Obecnie prowadzone są badania nad nowymi strategiami terapeutycznymi, które zmniejszyłyby endogenną syntezę patogennych izoprostanów. Sugeruje się, że 8-iso-PGF2α pośredniczy w patogenezie zespołu wątrobowo-nerkowego [9]. Oprócz tego związek ten jest generowany w dużych ilościach w organizmie człowieka, osłabiając farmakologiczne działanie niektórych niesteroidowych leków przeciwzapalnych (NSAIDs), w tym przeciwkrzepliwy wpływ aspiryny (kwas acetylosalicylowy). Hamowanie działania niektórych leków odbywa się poprzez stymulację receptora tromboksanu w błonie komórkowej płytek krwi. W warunkach stresu oksydacyjnego 8-iso-PGF2α może zwiększać ryzyko powikłań zatorowo-zakrzepowych u pacjentów z choro¬bami układu krążenia, w tym niedokrwiennego udaru mózgu lub zawału mięśnia serca [10]. Ponadto niektóre izoprostany, zwłaszcza 8-iso-PGE2, wykazują działanie prozapalne oraz zwiększają wrażliwość obwodowych receptorów bólowych na bodźce nocyceptywne. Działanie to może minimalizować przeciwbólowe działanie leków przeciwzapalnych, stosowanych w terapii stanu zapalnego indukowanego stresem oksydacyjnym [11].
Izoprostany - reaktywne związki chemiczne o wysokiej aktywności biologicznej
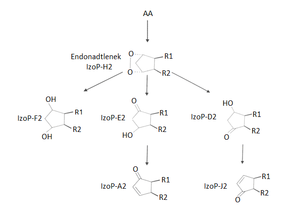
Istotnym intermediatem w szlaku syntezy izoprostanów jest endonadtlenek pochodnej cyklopentanu – izoprostan IzoP-H2. Związek ten w zależności od potencjału oksydoredukcyjnego komórki może ulegać izomerycznej rearanżacji, której następstwem jest redukcją cząsteczki do pochodnej cyklopentano-1,3-diolu (IzoP-F2) lub tylko rearanżacji (bez dalszej redukcji) do pochodnych 3-hydroksycyklopentanonu (IzoP-E2 lub IzoP-D2). Powstałe w wyniku tych przemian izoprostany IzoP-A2 oraz IzoP-J2 są wysoce reaktywnymi pochodnymi 2-cyklopenteno-1-onu (Rys.2) [12].
Rys.2. Szlak syntezy szeregu izoprostanów z kwasu arachidonowego (AA).
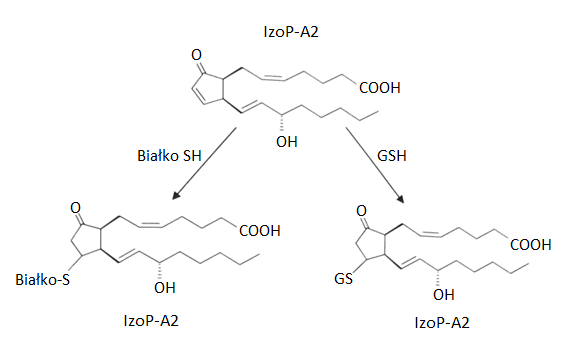
Synteza izoprostanów IzoP-F2 charakteryzuje się wysokim potencjałem redukcyjnym. Natomiast obniżenie puli komórkowego glutationu (GSH) bądź lipofilnego przeciwutleniacza α-tokoferolu prowadzi do powstawania izoprosta¬nów IzoP-E2 oraz IzoP-D2. Związki te ulegają następnie spontanicznej dehydratacji do struktury α,β-nienasyconego pierścienia cyklopentenonu, który jest charaktery¬styczny dla reaktywnych chemicznie izoprostanów IzoP-A2 oraz IzoP-J2. Związki te są niezwykle reaktywnymi elektrofilami, spontanicznie tworzącymi tzw. addukty Michaela (Ryc.3) z wolnymi grupami sulfhydrylowymi cysteiny wy¬stępującej licznie w białkach komórkowych i cząsteczkach glutationu [12].
Rys.3. Reakcja addycji Michaela – cyklopentenonowy izoprostan IzoP-A2 tworzy addukty z grupami tiolowymi białka lub glutationu (GSH), dając odpowiednio: białko-S-IzoP-A2 oraz GS-IzoP-A2.
Reakcje addycji izoprostanu IzoP-A2 i glutationu (GSH) katalizuje S-transferaza glutationu (GST). Powstały addukt lzoP-A2-GS może następnie ulegać hydrolizie katalizowanej przez dipeptydazę, co prowadzi do powstania adduktu IzoP-A2 z cysteina (Cys) lub N-acetylocysteiną (NAcCys) i obniżenia komórkowej puli glutationu. Jest to jeden z mechanizmów prooksydacyjnego działania IzoP pochodnych cyklopentenonu [13]. Oprócz tego izoprostan IzoP-A2 stymuluje mitochondrialną produkcję reaktywnych form tlenu. Prowadzi to do fosforylacji kinazy ERK1/2 oraz redoksowo wrażliwego adaptorowego białka p66shc, które biorą udział w transmisji sygnałów apoptotycznych w odpowiedzi na stres oksydacyjny w komórkach makrofagów. Prawdopodobnie mechanizm działania IzoP-A2 polega na kowalencyjnej modyfikacji podjednostki inhibitorowej czynnika transkrypcyjnego NF-kappaB, co upośledza proces jej degradacji i hamuje prozapalną aktywność biologiczną NF-kappaB. Ponadto wykazano, że izoprostan IzoP-J2 jest silnym aktywatorem PPARγ, chociaż wywoływany przez niego efekt przeciwzapalny jest niezależny od aktywacji PPARγ. Rozważa się także udział IzoP pochodnych cyklopentenonu w hamowaniu nadmiernie rozwiniętej reakcji zapalnej na zasadzie swoistego ujemnego sprzężenia zwrotnego. IzoP pochodne cyklopentenonu (IzoP-A2, IzoP-J2) ze względu na swoją wysoką reaktywność praktycznie nie występują w formie wolnej w płynach ustrojowych, w odróżnieniu od IzoP-F2 [14].
Izoprostany pochodne omega-3 wielonienasyconych kwasów tłuszczowych
Ostatnio prowadzone są liczne badania nad produktami enzymatycznej peroksydacji omega-3 wielonienasyconych kwasów tłuszczowych, zwłaszcza eikozapentaenowego (EPA) i dokozaheksanowego (DHA), którymi są pochodne izoprostanów, odpowiednio IzoP-F3 i IzoP-F4. Określane są one jako neuroprostany (NP). Wykazano, że pochodne te mogą być mediatorami efektów klinicznych związanych z suplementacją omega-3 nienasyconych kwasów tłuszczo¬wych, a przede wszystkim działania przeciwzapalnego, przeciwkrzepliwego i kardioprotekcyjnego. Suplementacją EPA zmniejsza produkcję IzoP-F2 z kwasu arachidonowego (AA). Dzieje się tak ponieważ EPA posiada więcej wiązań podwójnych niż kwas arachidonowy (AA), przez co łatwiej ulega spontanicznej peroksydacji, chroniąc komórkę przed prozapalnym i prooksydacyjnym wpływem IzoP-F2. Rozważa się zastosowanie neuroprostanów (NP) jako biomarkerów oksydacyjnego uszkodzenia mózgu w przebiegu wielu chorób neurodegeneracyjnych [15].
Bioaktywne izomery pochodne izoprostanów
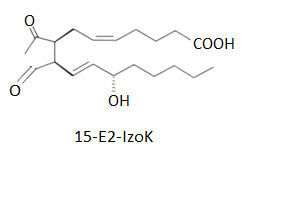
Do pochodnych izoprostanów należą izoketale (IzoK) (Rys.4). Są to bardzo reaktywne chemicznie związki o charakterze y-ketoaldehydu. Powstają one w wyniku izomerycznej rearanżacji IzoP-H2, który jest wytwarzany w warunkach stresu oksydacyjnego. W cząsteczce izoketalu występują obok siebie grupy aldehydowe i ketonowe. Dzięki temu IzoK mogą reagować z grupą ε-aminową białkowej reszty lizyny, tworząc zasadę Schiffa, która ulega dalszej rearanżacji do pochodnych pirolu. Izoketale mogą kowalencyjnie modyfikować białka, co prowadzi do sieciowania cząsteczki białka. Wszelkie modyfikacje cząsteczki białka mogą znacznie wpływać na jego strukturę i funkcję. Ponadto izoketale mogą pełnić funkcję mediatorów w prooksydacyjnej sygnalizacji izoprostanów, zwłaszcza pochodnych cyklopentenonu [16].
Rys.4. Wzór strukturalny IzoK-E2 z charakterystycznym motywem wysoce reaktywnego y-ketoaldehydu.
Kolejnymi pochodnymi izoprostanów są jasmonidy (kwas jasmonowy i jego estry) (Rys.5). Powstają one na skutek enzymatycznej lub nieenzymatycznej peroksydacji kwasu alfa-linolenowego (C18:3, omega-3). Jasmonidy należą do regulatorów wzrostu i rozwoju roślin. Odgrywają one ważną rolę w odpowiedzi na inwazję roślinożernych owadów, dzięki indukcji syntezy inhibitorów jelitowych proteaz trawiennych insektów. Jasmonidy wykazują podobieństwo strukturalne do prostanoidów, pochodnych kwasu arachidonowego (AA). Dzięki czemu związki te wywierają również bezpośredni wpływ na komórki zwierzęce. Wykazano, że kwas jasmonowy oraz jasmonian metylu indukują apoptozę komórek raka piersi, raka prostaty, czerniaka złośliwego oraz białaczki limfoblastycznej, przy czym nie wpływają one na zdrowe limfocyty. Ponadto jasmonidy te powodują nieapoptotyczną śmierć komórek chłoniaka B-komórkowego poprzez upośledzenie oksydacyjnej fosforylacji w mitochondriach [17].
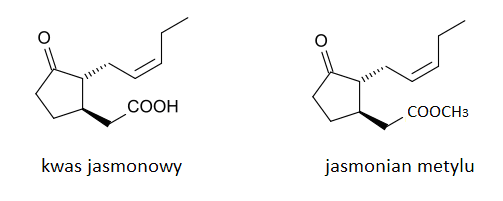
Rys 5. Wzór strukturalny kwasu jasmonowego i jasmonianu metylu.
W komórkach roślinnych produktami nieenzymatycznej peroksydacji kwasu alfa-linolenoiwego są krótsze (18-węglowe) analogi izoprostanów. Wykazano, że mogą one wywierać działanie patofizjologiczne na komórki i tkanki organizmu człowieka podobnie do izoprostanów. Prawdopodobnie fitoprostany występujące w pyłku brzozy mogą stymulować reakcję anafilaktyczną na alergen białkowy, powodując skurcz oskrzeli, co objawia się napadem astmy [18].
Podsumowanie
Odkrycie izoprostanów przyczyniło się do zrozumienia roli stresu oksydacyjnego w biologii i medycynie. Związki te są wiarygodny¬mi biomarkerami peroksydacji lipidów, mającymi znaczenie w diagnostyce patologii związanych ze stresem oksydacyjnym. Jedyną wadą izoprostanów jest fakt, iż są one nie tylko markerami, ale i mediatorami stresu oksyda¬cyjnego. Ponadto szlaki biosyntezy izoprostanów krzyżują się ze szlakami syntezy PG, i wzajemnie na siebie oddziałują.
Wciąż odkrywane są nowe pochodne izoprostanów, pełniące rolę mediatorów stresu oksydacyjnego lub modulatorów reakcji zapal¬nej. Wywierają one plejotropowy wpływ na komórki i tkanki organizmu poprzez mechanizm receptorowy i pozareceptorowy, przez co mogą wcho¬dzić w interakcje z niektórymi lekami.
Izoprostany IzoP-A2 oraz IzoP-J2 posiadające wysoce reaktywny pierścień cyklopentenonu charakteryzują się przeciwnowotworową ak¬tywnością biologiczną. Działanie przeciwnowotworowe IzoP jest związanie z inhibicją czynnika NF-kappa B i indukcją apoptozy. Ponadto wykazano, że pochodna izoprostanu 8-iso-PGF2α może indukować śmierć komórek nowotworowych opornych na apoptozę poprzez wakuolizację cytoplazmy. Obecnie trwają badanie nad poszukiwaniem pochodnych izoprostanów, zwłaszcza tioloreaktywnych pochodnych cyklopentenonu, w celu zwiększenia efektywności terapii przeciwnowotworowej.
Autor: Czuba Katarzyna
Literatura:
1. de Zwart L.L., Meerman J.H., Commandeur J.N., Vermeuln N.H. Biomarkers of Free Radical Damage Applications in Experimental Animals and in Humans. Free Redical Biology & Medicine. 1999. 26, 202-226.
2. Rokach J., Khanapure S. P., Hwang S. W., Adiyaman M., Lawson J. A. FitzGerald G. A. Nomenclature of isoprostanes: a proposal. Prostaglandins. 1997. 54, 853-873.
3. Tokarz A., Jelińska M., Ozga A. Izoprostany – nowe biomarkery lipidowej peroksydacji in vivo. Biul. Wydz. Farm. AMW. 2004. 2, 10-17.
4. Morrow J. W., Chen Y., Brame C. J., Yang J., Sanchez S. C., Xn J., Zeckert W. E. The Isoprostanes: Unique Prostaglandin – like Products of Free Radical Initiated Lipid Peroxidation. Drug Metabolism Reviews 1999. 31, 117-139.
5. Souvignet C., Cracowski J. L., Stanke-Labesque F., Bessard G. Are Isoprostans a Clinical Marker for Antioxidant Drug Investigation. Fundamental & Clinical Pharmacology. 2000. 14, 1-10.
6. Roberts L. J., Morrow J. D. The generation and actions of isoprostanes. Biochim. Biophys. Acta. 1997. 1345, 121-135.
7. Morrow J. D., Minton T. A., Badr K. F., Roberts L. J. Evidence that the F2-isoprostane, 8-epi-prostaglandin F2 alpha, is formed in vivo. Biochim. Biophyts. Acta. 1994. 1210, 244-248.
8. Morrow J. D., Awad J. A. Boss H. J., Blair I. A., Roberts L. J. Non-cyclooxygenase-derived prostanoids (F2-isoprostanes) are formed in situ on phospholipids. Proc. Natl. Acad. Sci. USA. 1992. 89. 10721-10725.
9. Morrow J. D., Moore K. P., Awad J. A., Ravenscraft M. D., Marini G., Badr K.F., Williams R., Roberts L. J. Marked overproduction of non-cyclooxygenase derived prostanoids (F2-isoprostanes) in the hepatorenal syndrome. J. Lipid Mediat. 1993. 6, 417-420.
10. Patrignani P. Aspirin insensitive eicosanoid biosynthesis in cardiovascular disease. Thromb. Res. 2003. 110, 281-286.
11. Evans A. R., Junger H., Southall M.D., Nicol G. D., Sorkin L. S., Broome J. T., Bailey T. W., Vasko M.R. Isoprostanes, novel eicosanoids that produce nociception and sensitize rat sensory neurons. J. Pharmacol. Exp. Ther. 2000. 293, 912-920.
12. Montine T. J., Montine K. S., Reich E. E., Terry E. S., Porter N. A., Morrow J. D. Antioxidants significantly affect the formation of different classes of isoprostanes and neuroprostanes in rat cerebral synaptosomes. Biochem. Pharmacol. 2003. 65, 611-617.
13. Blair I. A. Endogenous glutathione adducts. Curr. Drug Metab. 2006. 7, 853-872.
14. Musiek E. S., Gao L., Milne G. L., Han W., Everhart M. B.. Wang D., Backlund M. G., DuBois R. N., Zanoni G., Vidari G., Blackwell T. S.. Morrow J. D. Cyclopentenone isoprostanes inhibit the inflammatory response in macrophages. J. Biol. Chem. 2005. 280, 35562-35570.
15. Serhan C. N., Clish C. B., Brannon J., Colgan S. P., Chiang N., Gronert K. Novel functional sets of lipid-derived mediators with antiinflammatory actions generated from omega-3 fatty acids via cyclooxygenase 2-nonsteroidal antiinflammatory drugs and transcellular processing. J. Exp. Med. 2000. 192, 1197-1204.
16. Boutaud O., Brame C. J., Chaurand P., Li J. Rowlinson S. W., Crews B. C., Ji C., Marnett L. J., Caprioli R. M., Roberts L. J., Oates J. A. Characterization of the lysyl adducts of prostaglandin H-synthases that are derived from oxygenation of arachidonic acid. Biochemistry. 2001. 40, 6948-6955.
17. Fingrut O., Flescher E. Plant .stress hormones suppress the proliferation and induce apoptosis in human cancer cells. Leukemia. 2002. 16, 608-616.
18. Gilles S., Mariani V., Bryce M., Mueller M. J., Ring J., Behrendt H., Jakob T., Traidl-Hoffmann C. Pollen allergens do not come alone: pollen associated lipid mediators (PALMS) shift the human immune systems towards a T(H)2-dominated response. Allergy Asthma Clin. Immunol. 2009. 5, 3.
19. http://www-dsv.cea.fr/en/institutes/institute-of-biology-and-technology-saclay-ibitec-s/units/bioenergetics-structural-biology-and-mechanisms-sb2sm-ura2096-cnrs/oxidative-stress-and-detoxification-laboratory-lsod/detoxification-and-oxidative-stress.
http://laboratoria.net/artykul/16271.html










Recenzje