- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Bakteriofagi – cenne narzędzie współczesnej biotechnologii i medycyny
 Bakteriofagi są to wirusy, które atakują i replikują się w komór¬kach bakteryjnych. Wirusy te zostały odkryte niezależnie od siebie przez Felix Twort oraz Felix d'Herelle w drugiej dekadzie XX wieku. Od tego czasu wzbudzają one duże zainteresowanie ze względu na możliwość ich zastosowania w leczeniu niektórych chorób zakaźnych wywoływanych przez bakterie. Obecnie bakteriofagi są uważane za cenne narzędzie współczesnej biotechnologii i medycyny [1].
Bakteriofagi są to wirusy, które atakują i replikują się w komór¬kach bakteryjnych. Wirusy te zostały odkryte niezależnie od siebie przez Felix Twort oraz Felix d'Herelle w drugiej dekadzie XX wieku. Od tego czasu wzbudzają one duże zainteresowanie ze względu na możliwość ich zastosowania w leczeniu niektórych chorób zakaźnych wywoływanych przez bakterie. Obecnie bakteriofagi są uważane za cenne narzędzie współczesnej biotechnologii i medycyny [1]. Budowa bakteriofagów
Bakteriofagi są to wirusy bakteryjne zbudowane z materiału genetycznego otoczonego białkami strukturalnymi, które tworzą kapsyd. Materiał genetyczny bakterio¬fagów stanowi DNA lub rzadziej RNA w postaci jednoniciowej lub dwuniciowej. Zawiera on od kilku do kilkuset genów kodujących białka strukturalne (budujące kapsyd) oraz niestrukturalne biorące udział w replikacji wirusa. Kwas nukleinowy oprócz typowych zasad azotowych zawiera również zmodyfikowane zasady, które chronią go przed nukleazami gospodarza w trakcie infekcji fagowej. Genomy bakteriofagów różnią się wielkością, od 2,5 kpz do około 150 kpz. Ilość genów jest w przybliżeniu proporcjonalna do wielkości genomu [1].
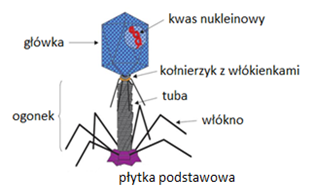
Kapsyd zwykle składa się z jednego rodzaju białka, odpornego na niszczące działanie czynników zewnętrznych. Pełni on funkcję ochronną dla materiału genetycznego wirusa, który bez niego uległby w środowisku naturalnym szybkiej inaktywacji i rozkładowi. Kapsyd bakteriofagów może mieć kształt heliakalny, izometryczny lub złożony, łączący w sobie obie formy. Pierwszy z nich, kapsyd helikalny jest zbudowany z helikalnie ułożonych podjednostek białkowych. Składa się on z jednego głównego białka kapsydu i czterech innych białek, zlokalizowanych na jego końcach. Helikalny kapsyd występuje u bakteriofagów z rodziny Inoviridae. Kolejny kapsyd bakteriofagów o strukturze izometrycznej zbudowany jest z podjednostek białkowych (kapsomerów), tworzących strukturę quasisferyczną. Struktura ta ma symetrię ikosaedralną, tzn. na jej dwudziestu równobocznych powierzchniach znajduje się około 60 identycznych elementów ułożonych w formie kulistej, połączonych ze sobą podwójną, trójkrotną i pięciokrotną osią symetrii. Kapsyd o strukturze izometrycznej występuje u bakteriofagów z rodziny Microviridae. Natomiast kapsyd bakteriofagów o złożonej strukturze zbudowany jest z wielościennej główki i ogonka (Rys.1). Głowa zbudowana jest z jednego lub kilku typów białek i ma za zadanie ochronę kwasu nukleinowego, który znajduję się w jej wnętrzu. W dolnej części główki kapsyd przechodzi w ogonek, który jest połączony z główką za pomocą białka łącznikowego. Ogonek składa się z wewnętrznej tubularnej struktury rdzeniowej, otoczonej kurczliwą, helikalną pochewką, przez którą następuje transfer kwasu nukleinowego podczas infekcji. Ogonek zakończony jest płytką podstawową, w którą wbudowane są białka enzymatyczne rozkładające ścianę komórkową bakterii. Od płytki podstawowej odchodzi sześć nitkowatych wypustek, które służą do rozpoznawania odpowiednich receptorów oraz przytwierdzania się do powierzchni komórek bakterii. Taką strukturę posiadają bakteriofagi rodzin Myoviridae, Siphoviridae i Podoviridae. Ponadto u niektórych fagów obserwuje się obecność dodatkowej lipoproteinowej osłonki [1].
Cykle replikacyjne bakteriofagów
Bakteriofagi charakteryzują się wysoką specyficznością. Zwykle jeden gatunek wirusa może namnażać się tylko w jednym gatunku bakterii lub jedynie w obrębie konkretnego jej szczepu [2].
Pierwszym etapem infekcji fagowej jest proces adsorpcji bakteriofaga do komórki bakteryjnej. W tym procesie ważną rolę odgrywa płytka podstawowa oraz włókienka, które rozpoznają specyficzne receptory na powierzchni gospodarza. Dochodzi do związania receptora bakteryjnego z włókienkiem faga. Następnie osłonka bakteriofaga oddziałuje z komórką bakteryjną. Niektóre fagi posiadają odpowiednie enzymy trawiące otoczkę bakteryjną. Następnie do wnętrza bakterii wprowadzany jest kwasu nukleinowy, który przechodzi przez ogonek bakteriofaga. Zwykle tylko jeden komponent fagowy bierze udział w transferze materiału genetycznego z wirusa do komórki bakteryjnej. W większości przypadków do komórki bakteryjnej wprowadzany jest tylko materiał genetyczny, natomiast pozostałe komponenty bakteriofaga pozostają na zewnątrz [2].
Wyróżniamy dwa cykle replikacyjne bakteriofagów: cykl lityczny oraz cykl lizogeniczny. Cykl lityczny jest to cykl życiowy bakteriofagów wirulentnych, których materiał genetyczny nie integruje z genomem gospodarza. Polega on na zakażeniu bakterii, namnożeniu nowych cząstek fagowych, rozpadzie bakterii i uwolnieniu nowych bakteriofagów. Po namnożeniu nowych fagów komórka gospodarza ulega lizie. Innym rodzajem cyklu życiowego bakteriofagów jest cykl lizygeniczny, w którym genom faga integruje z genomem gospo¬darza. Polega on na namnożeniu materiału genetycznego faga podczas podziałów komórkowych gospodarza, nie powodu¬jąc jego lizy. Zintegrowany materiał genetyczny ulega represji, z tego powodu nie są syntetyzowane białka fagowe. W takiej formie bakteriofag może przetrwać nawet kilka podziałów. W określonych warunkach fagowy DNA może ulec wycięciu z chromosomu bakteryjnego i wejść w cykl lityczny. Proces ten nie zawsze przebiega precyzyjnie i często do genomu bakteriofaga zostają włączone sekwencje DNA bakteryjnego, które mogą być przekazywane innym bakteriom podczas ich zakażenia. W tym wypadku bakteriofag pełni funkcję wektora przenoszącego materiał genetyczny z jednej komórki do drugiej. W ten sposób może powstać szczep oporny na leczenie[2].
Znaczenie bakteriofagów w biotechnologii
Enzymy bakteriofagów są wykorzystywane w biotechnologii i inżynierii genetycznej. Charakteryzuje je wysoka wydajność katalizy reakcji w której biorą udział. Obecnie wiele enzymów wytwarzanych przez bakteriofagi jest produkowana bez ich udziału w komórkach określonych szczepów bakterii, transformo¬wanych pojedynczymi genami tych wirusów [3].
Najczęściej wykorzystywane są enzymy fagów T – parzystych. Bakteriofag T4 dostarcza ligazy RNA, ligazy DNA, polimerazy DNA oraz kinazy polinukleotydowej. Ligaza RNA katalizuje łączenie ze sobą wiązaniami fosfodiestrowymi cząsteczek jednoniciowego RNA. Reakcja ligacji odbywa się z udziałem adenozynotrójfosforanu (ATP). Enzym ten znalazł zastosowanie do łączenia cząsteczek RNA, cyrkularyzacji krótkich jednoniciowych oligonukleotydów oraz do znakowania RNA za pomocą cytydyno-2,3-bisfosforanu (αP32). Natomiast ligaza DNA łączący wolne końce dwuniciowych cząsteczek DNA. Łączenie DNA następuje poprzez wytworzenie wiązania fosfodiestrowego pomiędzy końcem hydroksylowym 3` a końcem fosforowym 5` w reakcji zależnej od ATP. Enzym ten znalazł zastosowanie do klonowania fragmentów DNA do odpowiednich wektorów oraz do przyłączania fragmentów DNA do końców innej cząsteczki DNA. Ligaza DNA jest również powszechnie wykorzystywana w katalizowaniu łańcuchowej reakcji ligazy i naprawie nacięć w DNA. Z kolei polimeraza DNA faga T4 bierze udział w replikacji fagowego genomu. Wykazuje aktywność polimeryzacyjną w kierunku 5'-3' oraz egzonukleolityczną w kierunku 3'-5'. Enzym ten jest wykorzystywany do wypełniania („stępiania") wystających końców cząsteczek DNA, znakowania ich mar¬kerami radioaktywnymi lub fluorescencyjnymi oraz celu przeprowadzenia mutagenezy ukierunkowanej. Kolejny istotny enzym wytwarzany przez bakteriofaga T4 to kinaza polinukleotydowa. Białko to przenosi grupę gamma fosforanową z ATP na wolną grupę 5' hydroksylową jedno- lub dwuniciowego RNA lub DNA. Kinaza polinukleotydowa wykorzystywana jest do znakowania nukleotydów przy końcu 5' DNA za pomocą radioaktywnego fosforanu gamma oraz fosforyluje nukleotydy przy końcu 5' w DNA i RNA przed wykonaniem ligacji [3].
Również inne bakteriofagi dostarczają ważnych enzymów dla biotechnologii i biologii molekularnej. Bakteriofag T7 jest źródłem polimerazy RNA oraz polimerazy DNA. Polimeraza RNA odpowiada za wytwarzanie nici RNA na matrycy DNA w procesie zwanym transkrypcją. Enzym ten jest wykorzystywany w celu przeprowadzenia procesu transkrypcji w warunkach in vitro, np. w celu uzyskania znakowanych fragmentów RNA. W wielu laboratoriach używana jest także zmodyfikowana pochodna polimerazy RNA bakteriofaga T7 zwana sekwenazą. Enzym ten znalazł zastosowanie do sekwencjonowania DNA. Natomiast polimeraza DNA faga T7 jest enzymem katalizującym syntezę DNA z największą wydajnością. Enzym ten jest wykorzystywany w mutagenezie ukierunkowanej oraz przy wypełnianiu wystających końców DNA. Kolejną istotną polimerazą fagową jest polimeraza bakteriofaga phi 29. Enzym ten jest powszechnie wykorzystywany ze względu na zdolność do syntezy cząsteczki DNA bez udziału oligonukleotydowych starterów. Wówczas wymagana jest jednak obecność białka terminalnego na końcu nici DNA, które zastępuje starter. Ponadto polimeraza ta charakteryzuje się wysoką procesywnością oraz zdolnością do wymiany nici DNA. Polimeraza faga phi 29 znalazła zastosowanie do amplifikacji DNA metodą toczącego się koła oraz podczas przygotowywania DNA do sekwencjonowania. Ponadto w biotechnologii i inżynierii genetycznej stosowane są także polimerazy RNA pozyskiwane z bakteriofagów SP6 oraz P3. Posiadają one właściwości podobne do polimerazy RNA faga T7 [3].
Kolejnym ważnym enzymem jest egzonukleaza wytwarzana przez bakteriofaga λ. Enzym ten przekształca dwuniciowe cząsteczki DNA w jadnoniciowe fragmenty. Egzonukleaza bakteriofaga λ trawi podwójną nić DNA od strony końca 5'. Wymaga ona do swojego działania obecności grup fosforanowych od strony końca 5' nici DNA. Enzym ten jest wykorzystywany do sekwencjonowania produktów PCR o wysokiej zawartości par GC [3].
Bakteriofagi jako wektory genów
Genomy bakteriofagów są wykorzystywane do konstruowania wektorów przenoszących docelowe geny do komórek bakteryjnych i umożliwiających ich powielanie oraz ekspresję. W tym celu najczęściej stosuje się promotory pochodzące z bakteriofagów T3, T5, T7 oraz SP6 [4].
Po raz pierwszy jako wektora do klonowania DNA wykorzystano bakteriofaga λ. Jego genom stanowi dwuniciowy DNA w formie liniowej, zbudowany z około 48,5 tpz. Z materiału genetycznego bakteriofaga λ można usunąć duże fragmenty DNA. Pomimo braku części DNA nie traci on zdolności do replikacji. Umożliwia to wstawienie obcego fragmentu DNA w zwolnione miejsce. W celu umieszczenia zrekombinowanego DNA wirusa w kapsydzie, jego całkowita wielkość musi zawierać się w przedziale 38-53 kpz. Ponadto bakteriofaga λ posiada zdolność do cyrkularyzacji własnego DNA w komórce bakterii. Proces ten jest możliwy dzięki znajdującym się na końcach genomu faga λ sekwencjom cos, które zawierają komplementarne nukleotydy. Sekwencje te uczestniczą również w pakowaniu wirusowego DNA do kapsydu bakteriofaga. Sekwencje cos znalazły zastosowanie do konstruowania wektorów genetycznych zwanych kosmidami. Kosmidy posiadają zarówno cechy bakteriofagów jak i cechy właściwe plazmidom. Sekwencjami typowymi dla plazmidów są miejsce startu replikacji (ori), miejsce klonowania (MCS) oraz gen oporności na antybiotyk. Cechy te umożliwiają namnażanie się kosmidowego DNA w komórkach bakteryjnych w podobny sposób jak plazmidów. Kosmid wnika do komórki bakteryjnej podobnie jak bakteriofag w celu upakowania go do kapsydu wirusowego. Efekt ten można osiągnąć stosując mieszaninę pakującą, która zawiera białka bakteriofaga λ, pochodzące z modyfikowanych genetycznie bakterii lub z udziałem faga pomocniczego [4].
W celu klonowania DNA wykorzystywane są także inne wektory genetyczne fagemidy (fazmidy). Fazmidy podobnie jak kosmidy zawierają sekwencje bakteriofagowe i plazmidowe, jak miejsce replikacji dla DNA bakteriofaga (M13 lub f1) i E. coli, gen faga M13 z sekwencją promotorową i odpowiednim miejscem klonowania oraz geny oporności na antybiotyki. Wektory te nie posiadają sekwencji niezbędnych do wytworzenia pełnych cząstek fagowych. Fagemidy mogą być powielane jak plazmidy lub pakowane do kapsydu jako rekombinowane cząstki faga, w obecności w komórce faga pomocniczego [5].
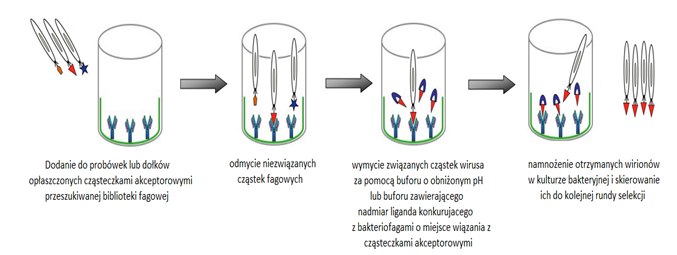
Wektory fagowe i fagemidowe znalazły zastosowanie do konstrukcji bibliotek cDNA, DNA kodującego przypadkowe peptydy lub fragmenty białek. Wektory te umożliwiły opracowanie techniki zwanej prezentacją fagową, która służy do badania oddziaływań białko-białko oraz interakcji białek z innymi cząsteczkami (Rys.2). W technice tej znalazły zastosowanie zmodyfikowane bakteriofagi nitkowate jak M13 i f1. Do genomu tych fagów wprowadza się odcinek DNA kodujący badany peptyd w taki sposób, aby uległ on ekspresji wraz z jednym z białek powierzchniowych jako peptyd fuzyjny.
Białkiem powierzchniowym może być białko główne płaszcza lub białko odpowiedzialne za adsorpcję wirusa na powierzchni komórki. Oddziaływania takich peptydów eksponowanych na powierzchni cząstek fagowych bada się, analizując adsorpcję fagów do cząsteczek akceptorowych opłaszczających powierzchnię stałą. Pierwszym etapem jest dodanie mieszaniny zawierającej zrekombinowane fagi do probówek lub dołków opłaszczonych cząsteczkami akceptorowymi. Następnie wymywa się nadmiar bakteriofagów z podłoża. Związane z powierzchnią stałą pozostają tylko te bakteriofagi, które zawierają peptydy swoiście oddziałujące z substancją opłaszczającą powierzchnię. W celu ustalenia najbardziej swoistych oddziaływań należy kilkakrotnie powtórzyć to postępowanie. Procedurę tę określa się jako przeszukiwanie biblioteki fagowej lub biopanning. Wyselekcjonowane bakteriofagi można ponownie namnożyć w komórkach bakteryjnych do dalszych badań [6].
Wklonowanie genu kodującego obce białko do genomu bakteriofaga może prowadzić do utraty infekcyjności wirusa. Z tego powodu takie wektory fa¬gowe zawierają dwie kopie genu wirusowego, jedną z wklonowanym egzogennym DNA oraz drugą pełną, która pozwala na syntezę cząsteczki fagowego białka. Za pomocą techniki prezentacji fagowej najczęściej poddawane są ekspresji przeciwciała lub antygeny, dla których poszukuje się specyficznie oddziałujących przeciwciał. Zastosowanie tej metody pozwala na wytworzenie dużej liczby swoistych przeciwciał bez immunizacji, poza organizmem gospodarza. Fakt ten jest istotny dla antygenów o wysokiej toksyczności [7].
W celu otrzymania fragmentów DNA kodujących przeciwciała, wykonuje się izolację mRNA z krwi obwodowej, szpiku kostnego lub śledziony, a następnie przepisuje się je do DNA i powiela za pomocą technik RT-PCR. Możliwe jest także wykonanie izolacji mRNA po immunizacji swoistym antygenem. Biblioteki fagowe są powszechnie wykorzystywane w badaniach nad odpowiedzią immunologiczną organizmu. Stosowane są one zarówno w badaniach dia¬gnostycznych, jak również immunoterapii. Przygotowane przeciwciała są następnie wykorzystywane do identyfikacji marke-rów na powierzchni komórek. Badanie to można prowadzić stosując komórki, skrawki tkanek pobrane z organizmu, jak również in vivo. W przypadku stosowania tej techniki in vivo zmodyfikowane bakteriofagi wstrzykuje się bezpośrednio do ustroju i poszukuje się miejsca, w którym doszło do ich adsorpcji [8].
Po wyselekcjonowaniu bakteriofagów można otrzymać kodowa¬ne przez nie przeciwciała oraz inne białka w formie rozpuszczal¬nej, klonując odpowiednie sekwencje do wektorów umożliwiających wy¬dzielanie białek do przestrzeni periplazmatycznej bakterii. Najczęściej stosuje się wektory fagemidowe, z których następnie wycinane są sekwencje kodujące białka bakteriofaga. Peptydy wyselekcjonowane za pomocą biblioteki fagowej z wykorzy¬staniem specyficznych przeciwciał mogą być stosowane do ich antagonizacji w leczeniu chorób autoimmunizacyjnych. Możliwe jest także otrzymywanie nowych inhibitorów enzymów przydatnych w leczeniu niektórych schorzeń. Natomiast fragmenty DNA kodujące część antygenów ulegających ekspresji z ge¬nem kodującym białko kapsydu bakteriofaga mogą być wykorzystane do mapowania epitopów rozpoznawanych przez przeciwciała mono- i poliklonalne oraz do poszukiwania dla nich odpowiednich przeciw¬ciał. W ten sposób zostały zidentyfikowane specyficzne epitopy dla wirusa grypy czy zapalenia wą¬troby typu C [9].
Informacje uzyskane za pomocą bibliotek fagowych mogą pomóc w przygotowaniu nowej klasy szczepionek przeciw wirusowi grypy, jak również swoistych przeciwciał do neutralizacji zakażeń. Przeciwciała zawarte w surowicy pacjentów wiąże się z odpowiednim podłożem lub magnetyczną kuleczką w celu ułatwienia selekcji. Podobna metoda jest stosowana do identyfikowania odpowiednich epitopow w prionach. Istnieje możliwość wykorzystania wyselekcjonowanych przeciwciał do zapobiegania agregacji białka prionowego [10]. Ponadto peptydy wyizolowane z biblioteki fagowej zostały także zastosowane do wiązania integryn, które są niezbędne do zakotwiczenia, różnicowania oraz migracji komórek. W ten sposób zapobiegają one inwazji nowotworu czy degradacji płytek krwi [11].
Zastosowanie bakteriofagów w terapii (fagoterapia)
Rosnąca liczba gatunków bakterii opornych na większość an¬tybiotyków zadecydowała o próbie wykorzystania bakteriofagów w leczeniu zakażeń bakteryjnych. Wirusy bakteryjne znalazły zastosowanie w terapii ropnych zakażeń bakteryjnych skóry, duru brzusznego i czerwonki [12].
W fagoterapii wykorzystuje się naturalną zdolność bakteriofagów do zakażania komórek bakterii oraz ich lizy podczas uwalniania cząstek po¬tomnych wirusa. Istotne jest aby przed rozpoczęciem leczenia zidentyfiko¬wać czynnik etiologiczny zakażenia i wybrać swoisty szczep bakteriofaga, który wykazuje najwyższy potencjał lityczny w stosun¬ku do danego szczepu bakterii. W fagoterapi stosuje się zarówno bakteriofagi o wąskim, jak i szerokim spektrum działania, w zależności od bakterii powodujących skażenia. Natomiast nie możliwe jest stosowanie bakteriofagów posiadających lizogenny cykl życiowy. Do pierwszych dostępnych w handlu preparatów fagowych o działaniu przeciwbakteryjnym należą: Bacte-coli-phage, Bacte-rhinophage, Bacte-intestiphage, Bactepuophage i Bacte-staphyphage oraz produkty fagowe stosowane u ludzi przeciw zakażeniom Staphylococci, Streptococci i Escherichia coli [12].
Próby zastosowania preparatów fagowych u ludzi wykazały, że są one całkowicie skuteczne i bezpieczne. Przeprowadzono badania nad wykorzystaniem bakteriofagów w leczeniu rożnych zakażeń bakteryjnych, takich jak ropne zakażenia skóry, płuc, opłucnej, nerek czy układu żołądkowo-jelitowego. Głównymi czynnikami etiologicznymi tych zakażeń były bakterie z rodzaju Staphylococcus, Pseudomonas, Escherichia, Klebsiella oraz Salmonella, w tym także mutanty oporne na wiele różnych grup antybiotyków. Fagoterapię zastosowano u 550 pacjentów u których leczenie antybiotykami nie przynosiło oczekiwanego efektu. Bakteriofagi mogą być aplikowane osobom zakażonym na wiele sposobów: doustnie w postaci tabletek i roztworów, dożylnie, doosierdziowo i wewnątrzotrzewnowo a także domiejscowo (skóra, oczy, nos, błona śluzowa). Pozytywną odpowiedź na terapię stwierdzono u 508 pacjentów (92,4%), u 38 (6,9%) zaobserwowano przejściową poprawę, a u 4 (0,7%) terapia nie przyniosła żadnego rezultatu [13]. Obecnie bakteriofagi stosuje się w leczeniu zakażeń kości, nie gojących się ran pooperacyjnych, górnych dród oddechowych, przewodów moczowych i organów rozrodczych, wywołanych przez Staphylococcus, Pseudomonas, Escherichia, Klebsiella, Salmonella oraz Enterococcus, Citrobacter, Enterobacter, Shigella, Serratia, Proteus, Stenotrophomonas i Stahylococcus, w tym metycylinooporny Staphylococcus aureus (MRSA) i wankomycynooporny (VRSA) [14].
W porównaniu z antybiotykami, bakteriofagi charakteryzują się wysoką swoistością względem gospodarza. Atakują one konkretny szczep bakterii, nie niszcząc przy tym naturalnej flory bakteryjnej. Zastosowanie bakteriofagów w terapii nie powoduje również silnych efektów ubocznych jak alergie. Stwierdza się natomiast występowanie nudności, biegunek, podwyższenie temperatury ciała i pogorszenie samopoczucia pacjentów, zwiazanych z uwolnieniem endotoksyn podczas lizy komórek bakte¬ryjnych. Są to jednak efekty uboczne, które towarzyszą także antybiotykoterapii. W przypadku podawania przez dłuższy czas preparatów zawierających bakteriofagi stwierdzono wzrost miana przeciwciał IgG i IgM w surowicy. Ponadto pomimo uzyskania przez bakterię oporności na działanie bakteriofaga, pozostaje ona wrażliwa na inne szczepy o tej samej swoistości w stosunku do gospodarza. Za bezpieczeństwem stosowania bakteriofagów przemawia fakt, że są one wszechobecne, co ułatwia również ich pozyskiwanie. Bakteriofagi izoluje się z miejsc naturalnego występowania ich gospodarzy. Najważniejszą zaletą wirusów bakteryjnych jest ich zdolność do namnażania się w organizmie tak długo, jak długo obecne są komórki odpowiedniego gospodarza. Po dotarciu do miejsca zakażenia następuje wykładniczy wzrost liczby czą¬steczek bakteriofaga. Dzięki czemu nie jest wymagane ich wielokrotne podawanie w celu osiągnięcia pożądanego efektu terapeutycznego [14].
Ostatnio prowadzi się wiele badań nad stosowaniem w fagoterapii bakteriofagów modyfikowanych genetycznie. Mogą one stanowić nośnik leków w terapii celowanej. W tym przypadku do bakteriofaga rozpoznającego określony szczep bakterii dołącza się zmodyfikowany lek w formie proleku, który następnie zamienia się w lek po dotarciu do bakterii i oddysocjowaniu od faga [15]. Trwają próby nad zastosowaniem fagów nitkowatych w terapii nowotworów. Wykazano, że leki przeciwnowotworowe związane z fagami są ponad 1000-krotnie bardziej efektywne w zwalczaniu komórek nowotworowych niż podane w formie wolnej [16].
Białka pochodzenia fagowego jako czynniki terapeutyczne
Zastosowanie bakteriofagów w terapii ma też swoje wady. Poważnym zagrożeniem jest udział fagów w horyzontalnym transferze ge¬nów co może doprowadzić do powstania nowych groźnych szczepów bakterii. Oprócz tego problem stanowi słaba penetracja cząstek fagowych do wielu tkanek pacjenta, immunogenność wirionów oraz trudne otrzymywanie dostatecznie oczyszczonych preparatów. Wiele z tych problemów można ominąć, stosując zamiast całych cząstek wirusowych, jedynie ich cz꬜ci, jak na przykład białka posiadające aktywność przeciwbakteryjną. Zastosowanie takiej metody eliminuje horyzontalny transfer genów oraz ułatwia penetrację czynnika terapeutycznego do tkanek objętych zakażeniem. Kolejną zaletą stosowania białek pochodzenia fagowego jako czynników terapeutycznych jest ograniczenie liczby epitopów co może sprawić, że preparaty zawierające pojedyncze biał¬ka będą mniej immunogenne [17].
Szczególnie interesującą grupą białek wykorzystywaną jako czynniki terapeutyczne są endolizyny fagowe. Są to enzymy wytwarzane przez bakteriofagi dsDNA np. z ro¬dzin Myoviridae, Siphouiridae czy Podoviridae. Endolizyny fagowe posiadają w swojej strukturze domenę przy końcu N, odpowiedzialną za aktywność enzymatyczną, oraz domenę przy końcu C, pozwalającą na specyficzne wiązanie z określonymi cukrami ściany komórkowej. Endolizyny biorą udział w lizie ściany komórkowej bakterii od wewnątrz, co w następstwie prowadzi do uwal¬niania wirionów potomnych z komórki. Enzyme te posiadają aktywność amidazy przecinającej wiązania amidowe między glikanem a mostkiem peptydowym, glukozamidazy lub lizozymu przecinających wiązania pomiędzy aminocukrami mureiny, lub endopeptydazy rozcinającej mostki peptydowe [18].
Idealnym celem dla endolizyn fagowych są bakterie kolonizujące błony śluzowe, ze względu na ich słabszą penetrację w porównaniu do leków niskocząsteczkowych. Dzieje się tak, ponieważ białka te dobrze dyfundują przez otoczki śluzowe bakterii. Podejmowano także próby zastosowania endolizyn fagowych w leczeniu zakażeń systemicznych. Poza terapią chorób bakteryjnych u ludzi, lizyny bakteriofagów mogą być także wykorzy¬stane w testach diagnostycznych na obecność niektórych bakterii czy jako środki ochrony roślin (bakteriocydy). Trwają także badania nad zastosowaniem genetycznie modyfikowanych bakterii probiotycznych produkują¬cych endolizyny lub samych białek jako dodatków do żywności, przeciw¬działających rozwojowi w niej bakterii patogennych [19].
Od czasu odkrycia bakteriofagów i poznania ich swoistości w rozpoznawaniu bakterii oraz zdolności do lizy komórek bakteryjnych, z powodzeniem wirusy te próbowano zastosować w leczeniu zakażeń bakteryjnych. Bakteriofagi stosowane są także do identyfikacji bakterii chorobo-twórczych oraz odgrywają ważną rolę w utrzymywaniu równowagi w populacjach bakterii zasiedla-jących różne ekosystemy. Mają wpływ nie tylko na ich skład, ale również na ich różnorodność genetyczną poprzez proces transdukcji. Ponadto bakteriofagi dostarczają cennych enzymów znajdujących szerokie zastosowanie w biotechnologii i inżynierii genetycznej. Natomiast genomy fagów są wykorzystywane do konstruowania wektorów przenoszących docelowe geny do komórek bakteryjnych i umożliwiających ich powielanie oraz ekspresję. Rozwój inżynierii ge¬netycznej oraz lepsza znajomość natury tych wirusów stwarza szerokie możliwości ich praktycznego wykorzystania w diagnostyce, tera¬pii licznych chorób, biologii molekularnej oraz biotechnologii.
Autor: Katarzyna Czuba
Literatura:
1. Winter P. C., Hickey G. I., Fletcher H. L. Krótkie wykłady- Genetyka. Wyd. Nauk. PWN. 2000.
2. Weinbauer M. G. Ecology of prokaryotic viruses. FEMS Microbiol. Rev. 2004. 28, 127-181.
3. Primrose S. B., Twyman R. M. Genomics Applications in Human Biology. Blackwell Publishing. Oxford. 2005.
4. Sambrook J., Fritsch E. F., Maniatis T. Molecular cloning. Laboratory manual. 2nd ed. Cold Spring Harbour Laboratory Press. 1989.
5. Mead D. A., Kemper B. Chimeric single-stranded DNA page-plasmid cloning vectors. Biotechnology. 1988. 10, 85-102.
6. Newton J., Deutscher S. L. Phage peptide display. Handb Exp. Pharmacol. 2008. 185, 145-163.
7. Hoogenboom H. R., de Bruine A. P., Hufton S. E., Hoet R. M., Arends J. W., Roovers R. C. Antibody phage display technology and its applications. Immunotechnology. 1998. 4, 1-20.
8. Li X. B., Schluesener H. J., Xu S. Q. Molecular addresses of tumors: selection by in vivo phage display. Arch. Immunol. Ther. Exp. 2006. 54, 177-181.
9. Kashyap A. K., Steel J., Oner A. F., Dillon M. A., Swale R. E., Wall K. M., Perr K.I., Faynbaym A., Ilhan M., Horowitz M., Horowitz L., Palese P., Bhatt R. R., Lerner R. A. Combinatorial antibody libraries from survivors of the Turkish H5N1 avian influenza outbreak reveal virus neutralization strategies. Proc. Natl. Acad. Sci. 2008.105, 5986-5991.
10. Petrez D., Williamson R. A., Kaneko K., Vergara J., Leclerc E., Schnitt-Ulns G., Mehlhorn I.R., Legname G., Wormald M. R., Rudel P. M., Dwek R. A., Burton D. R., Pruisner S. B. Antibodies inhibit prion propagation and clear cell cultures of prion infectivity. Naturę. 2001. 412, 739-743.
11. Koivunen E., Wang B., Ruoslahti E. Phage libraries displaying cyclic peptides with: different ring sizes: ligand specificities of the RGD-directed integrins. Biotechnology. 1995. 13, 265-270.
12. Sulakvelidze A., Alavidze Z., Morris J. G. Bacteriophage Therapy. Anfimicrob. Agents Chemother. 2001. 45, 649-659.
13. Slopek S., Weber-Dabrowska B., Kucharewicz-Krukowska. Dobrowski M. Re¬sults of bacteriophagetreatment of suppurative bacterial infections in year 1981-1986. Arch. Immunol. Ther. Exp. 1987. 35, 569-583.
14. Międzybrodzki R., Borysowski J., Fortuna W., Weber-Dąbrowska B., Górski A. Terapia fagowa jako alternatywa w leczeniu zakażeń wywołanych przez bakterie antybiotykooporne. Kardiochirur. Torakochir. Pol. 2006. 3, 201-205.
15. Yacoby I., Bar H., Benhar I. Targeted Drug-Carrying Bacteriophages as Antibacterial Nanomedicines. Antimictob. Agents Chemother. 2007. 51, 2156-2163.
16. Bar H., Yacoby I., Benhar I. Killing cancer cells by targeted drug-carrying phage nanomedicines. BMC Biotechnol. 2008. 3, 37.
17. Borysowski J., Weber-Dąbrowska B., Górski A. Bacteriophage Endolysins as a Novel Class of Antibacterial Agents. Exp. Biol. Med. 2006. 4, 366-377.
18. Jado I., López R., Garcia E., Fenoll A., Casal J., Garcia P. Phage lytic enzymes as therapy for antibiotic-resistant Streptococcus pneumoniae infection in a murine sepsis model. J. Antimicrob. Chemother. 2003. 52, 967-973.
19. Wang Y., Sun J. H., Lu C. P. Purified recombinant phage lysin LySMP: an extensive spectrum of lytic activity for swine streptococci. Curr. Microbiol. 2009. 58, 609-615.
20. http://www.phmd.pl/fulltxthtml.php?ICID=910880.









Recenzje