- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Instytucje zaangażowane w wydawanie pozwoleń i prowadzenie badań klinicznych według obowiązujących norm. Regulacje prawne w Polsce i Unii Europejskiej cz.II
 Współczesna medycyna stale się rozwija, lecz mimo olbrzymiej wiedzy na temat chorób oraz dostępnych leków, niektórych chorób wciąż nie jesteśmy w stanie skutecznie leczyć. Jest to powodem, dla którego niezwykle ważne jest poszukiwanie nowych substancji, sposobu ich zastosowania, co może przybliżyć badaczy do wynalezienia leków na wiele nieuleczalnych jak dotąd chorób. Substancje te są odkrywane oraz testowane na drodze wieloletnich eksperymentów laboratoryjnych oraz prób na zwierzętach doświadczalnych. Te substancje, które rokują największe nadzieje na skuteczne zastosowanie w walce z chorobami są poddawane testom z udziałem ludzi, czyli badaniom klinicznym.
Współczesna medycyna stale się rozwija, lecz mimo olbrzymiej wiedzy na temat chorób oraz dostępnych leków, niektórych chorób wciąż nie jesteśmy w stanie skutecznie leczyć. Jest to powodem, dla którego niezwykle ważne jest poszukiwanie nowych substancji, sposobu ich zastosowania, co może przybliżyć badaczy do wynalezienia leków na wiele nieuleczalnych jak dotąd chorób. Substancje te są odkrywane oraz testowane na drodze wieloletnich eksperymentów laboratoryjnych oraz prób na zwierzętach doświadczalnych. Te substancje, które rokują największe nadzieje na skuteczne zastosowanie w walce z chorobami są poddawane testom z udziałem ludzi, czyli badaniom klinicznym. Postęp w medycynie, opracowanie wielu nowych leków i terapii – sprawiły, że dziś potrafimy poradzić sobie z wieloma chorobami, które jeszcze niedawno uznawane były za nieuleczalne. W ciągu ostatnich 20 lat naukowcy odkryli i opracowali ponad 300 nowych leków, szczepionek i produktów medycznych, które zostały wprowadzone do obrotu i pozwalają skuteczniej leczyć ponad 150 różnych chorób. To niektóre przykłady przełomowych odkryć w medycynie w ostatnich latach. Żadne z nich nie byłoby możliwe bez prowadzenia badań klinicznych:
W 1995 dzięki opracowaniu inhibitorów proteazy oraz późniejszym badaniom nad ulepszeniem leków i terapii współczynnik umieralności wśród chorych na AIDS spadł o 70%.
12 lat temu nie było leku, który umożliwiałby skuteczne przeciwdziałanie rozwojowi choroby Alzheimera. Dziś dostępne są trzy różne grupy leków, które spowalniają postęp choroby i łagodzą jej objawy.
Jeszcze 50 lat temu ogromny lęk budziła choroba Heinego-Medina (polio), bo wiązała się z dużym ryzykiem zgonu. Dzięki wynalezieniu szczepionki w większości regionów świata udało się ją skutecznie opanować. Światowa Organizacja Zdrowia (WHO) ogłosiła w 2002 roku, że Europa jest wolna od tej choroby.
Polski rynek badań klinicznych
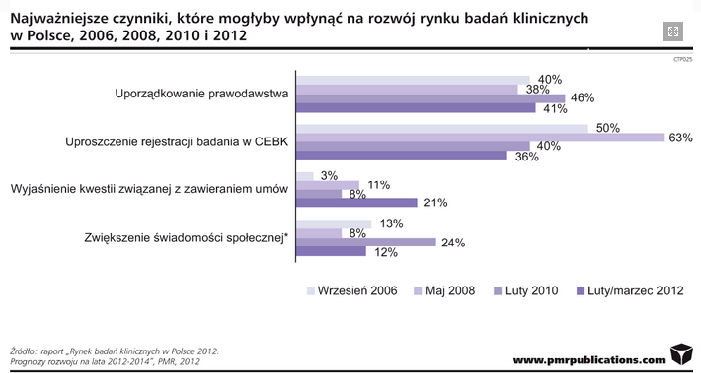
http://www.pmrpublications.com/press-releases/337/rynek-badan-klinicznych-w-polsce-rosnie-ale-wolno
Polska jest jednym z najbardziej atrakcyjnych krajów regionu ze względu na wielkość populacji, dużą chęć pacjentów do uczestnictwa w badaniach ze względu na słaby dostęp do innowacji oraz wysoką jakość infrastruktury związanej z przeprowadzaniem badań klinicznych. Globalny rynek badań klinicznych wart jest ok. 50-80 mld dolarów. W 2009 roku na całym świecie zarejestrowano ponad 17 tysięcy nowych badań klinicznych.
Szacuje się, że rynek badań klinicznych w Polsce wart jest około 860 mln złotych. Badania kliniczne wnoszą szereg pozytywnych impulsów, z których korzysta polska gospodarka oraz społeczeństwo. Dotyczy to zarówno korzyści materialnych jak i niematerialnych. W 2009 roku w Polsce zarejestrowano 469 nowych badań klinicznych, co stanowi ok. 2, 5%-3% wszystkich nowych badań zarejestrowanych na świecie. Obserwuje się proces przenoszenia części badań klinicznych na rynki rozwijające się (np. Azja) gdzie koszty są mniejsze, a rekrutacja pacjentów łatwiejsza. Ważna jest jednak jakość i zapewnienie określonych standardów. Najwięcej badań klinicznych nadal jest prowadzonych w Stanach Zjednoczonych i Europie Zachodniej głównie, dlatego iż są to największe rynki sprzedaży leków innowacyjnych.
Polska zajmuje dziesiątą pozycję na świecie i pierwszą wśród rynków wschodzących pod względem liczby prowadzonych badań klinicznych. Struktura polskiego rynku różni się od globalnego z punktu widzenia współczesnych trendów – np. firmy CRO obsługują większość badań (70% pod względem ilości i 53% pod względem ich wartości).
INFARMA
W październiku 2010 roku INFARMA- Związek Pracodawców Innowacyjnych Firm Farmaceutycznych i Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce przyjęły dokument „Zasady prowadzenia badań klinicznych”, który jest przykładem samoregulacji branży, wynikającej z dążenia do działania w myśl klarownych reguł. INFARMA reprezentuje 32 działających w Polsce wiodących firm sektora farmaceutycznego, prowadzących działalność badawczo-rozwojową i produkujących leki innowacyjne, w tym biotechnologiczne. INFARMA jest członkiem European Federation of the Pharmaceutical Industries and Associations (EFPIA). Została utworzona w sierpniu 2006 roku.
Celem INFARMY jest podejmowanie inicjatyw pozytywnie wpływających na tworzenie rozwiązań systemowych w dziedzinie ochrony zdrowia. Rozwiązania te powinny pozwalać pacjentom na korzystanie z nowoczesnych i najbardziej skutecznych terapii tak, by polskie standardy leczenia odpowiadały światowym. Do najważniejszych zadań INFARMY należą również działania zmierzające do dalszej regulacji na rynku leków w Polsce. Dotyczy to wprowadzenia jasnych procedur rejestracji leków oraz zasad ich refundacji. Innowacyjnym firmom farmaceutycznym skupionym w INFARMIE zależy również na tym, aby badania kliniczne w Polsce były prowadzone w myśl najwyższych światowych standardów jakościowych oraz norm etycznych. Ważna jest też przejrzystość i jednoznaczność przepisów, ponieważ przekłada się to wprost na sprawność w zakresie prowadzenia badań klinicznych. Organizacja zabiega również o przestrzeganie zasad prawnych w tym obszarze promocji i reklamy leków.
Swoimi działaniami Związek Pracodawców Innowacyjnych Firm Farmaceutycznych dąży do pokazania, że obecność zagranicznych producentów na polskim rynku farmaceutycznym oznacza dla naszych pacjentów dostęp do nowoczesnych leków. Może to w dużej mierze stanowić o poprawie stanu zdrowia społeczeństwa. Korzyści odnosi również gospodarka państwa w postaci inwestycji, podatków oraz transferu know-how.
AstraZeneca
AstraZeneca jest jedną z największych firm farmaceutycznych na świecie, która dostarcza nowoczesne leki na najpoważniejsze choroby stanowiące wyzwanie dla współczesnej medycyny. Firma przeznacza znaczne fundusze na badania kliniczne - rocznie na prace nad nowymi lekami wydaje ponad 4 mld dolarów. W 1992 r. powołano polskie przedstawicielstwo firmy Astra, które w 1998 roku zmieniło nazwę na Astra Pharmaceuticals Poland Sp. z o.o. Po konsolidacji firmy z Zeneca Polska Sp. z o.o. została utworzona, po dziś dzień obowiązująca, nazwa AstraZeneca Pharma Poland. W Polsce funkcjonuje jeden z największych działów badań klinicznych, który umożliwia lekarzom i pacjentom uczestnictwo w licznych międzynarodowych programach badawczych oraz zapewnia dostęp do najnowszych osiągnięć medycyny. Opracowując i dostarczając przełomowe leki od wielu lat przyczynia się do poprawy zdrowia pacjentów na całym świecie. Zajmuje się również budowaniem wśród pacjentów świadomości zagrażających im chorób oraz edukacją na temat profilaktyki, dostępnych metod terapii i poprawy jakości życia podczas leczenia.
Firma od początku swojego istnienia nieustannie kładzie duży nacisk na rozwój. Kluczowe znaczenie ma działalność badawczo-rozwojowa, ponieważ badania kliniczne są istotnym filarem innowacyjności firmy. AstraZeneca globalnie podejmuje liczne inicjatywy w zakresie działalności badawczo-rozwojowej (Research and Development, R&D). Działa w oparciu o długoterminową strategię, która pozwala na przekształcanie pomysłów naukowych w innowacyjne leki, stanowiące istotny postęp w medycynie i służące pacjentom na całym świecie. Zatrudnia ponad 15 000 osób, które zajmują się badaniami klinicznymi na całym świecie. Globalnie prowadzi około 140 projektów badawczych, z czego duża część jest w zaawansowanych fazach realizacji.
Polski Dział Badań Klinicznych prowadzi swoją działalność w ramach Regionalnego Ośrodka Badań Klinicznych Europy Środkowo-Wschodniej, Bliskiego Wschodu i Afryki (Clinical Research Region Central-Eastern Europe, Middle-East and Africa – CRR-CEEMEA), ale jest integralną częścią firmy AstraZeneca w Polsce. Obecnie region obejmuje 10 krajów (Afryka Południowa, Bułgaria, Czechy, Izrael, Polska, Rosja, Rumunia, Słowacja, Ukraina, Węgry), mając łącznie około 300 pracowników. W polskim Dziale Badań Klinicznych pracuje około 40 osób – są to głównie specjaliści: monitorzy i administratorzy badań klinicznych oraz osoby odpowiadające za kontrolę jakości, prowadzi rocznie około 30 badań we współpracy z dziesiątkami ośrodków: klinik, oddziałów szpitalnych, przychodni i gabinetów lekarzy rodzinnych.
W 2011 roku AstraZeneca uruchomiła Centrum Operacyjne, które zajmuje się planowaniem i koordynacją badań klinicznych na całym świecie. Badania leków prowadzone były przez Działy Medyczne polskich firm Astra oraz Zeneca od chwili ich powstania. Działalność ta znacznie rozwinęła się, gdy 15 marca 1995 r. stworzony został w Polsce Ośrodek Badań Klinicznych w ramach Centrum Badawczego Europy Środkowo-Wschodniej firmy Astra (ACRU/CE), którego centrala mieściła się w Budapeszcie.
AstraZeneca stara się nieść pomoc chorym opracowując nowe metody i środki leczenia, których skuteczność i bezpieczeństwo najpełniej potwierdzają badania kliniczne.
Najważniejszym warunkiem do przeprowadzenia badania klinicznego leku są osoby chętne do dobrowolnego wzięcia w nim udziału. Jeśli sponsor nie zbierze odpowiedniej grupy do przeprowadzenia na niej badań nie może ono dojść do skutku. Liczba osób potrzebna do danego projektu jest różna, zależy od celu, założenia badania, a także od jego przedmiotu, czyli badanej substancji. Określana jest przez zespół badaczy i podawana w protokole badania. Im większa jest grupa tym bardziej wiarygodne są wyniki. Ważne jest również, by w badaniach klinicznych uczestniczyły osoby podobne do tych, które będą przyjmowały badane leki po ich zarejestrowaniu. Jeśli leki badane są w „idealnej” grupie osób wówczas mogą wydawać się bardziej obiecujące, niż gdy będą stosowane w realnym świecie. Większość leków badanych jest najpierw u osób dorosłych, znacznie później, – jeśli w ogóle – u dzieci.
Według szacunków Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce w badaniach klinicznych prowadzonych w naszym kraju mogło do tej pory uczestniczyć nawet 200.000 pacjentów. Szacuje się, że co roku kilkanaście tysięcy polskich pacjentów wyraża świadomą zgodę na udział w badaniach klinicznych nowych leków.
Osoba zainteresowana uczestnictwem w badaniu klinicznym powinna przede wszystkim przedyskutować tę kwestie ze swoim lekarzem. Może on także pomóc w znalezieniu stosownego badania. Lekarz ma obowiązek wyczerpującego wyjaśnienia pacjentowi wszelkich związanych z nimi zagadnień przed podjęciem przez niego decyzji, aby mógł rozważyć wszystkie za i przeciw. Osoba wyrażająca chęć przystąpienia do badania powinna w trosce o własne dobro zdobyć jak najwięcej informacji.
Udział w badaniu klinicznym ma wiele zalet m.in. aktywne uczestnictwo w zwalczaniu choroby, dostęp do innowacyjnego leku lub metody leczenia, dostęp do procedur medycznych i diagnostyki na wysokim poziomie, możliwość wykonywania szerokiego zakresu badań, często niedostępnych w podstawowej lub nawet specjalistycznej opiece medycznej, ścisła kontrola procedur leczenia, zazwyczaj zwrot kosztów dojazdu na badania, ale z wykluczeniem pokrycia kosztów badań za granicą. Większość osób wyrażających zgodę na udział w badaniach klinicznych ma nadzieję, że udział w nich poprawi ich stan zdrowia, jakość i długość życia. Uczestnicy prób mogą być przecież pierwszymi, którzy odniosą korzyści z zastosowania nowego leku. Udział pacjenta w badaniu klinicznym jest bezpłatny. Wszelkie koszty leczenia (koszt badanych leków, specjalistycznych badań oraz opieki lekarskiej) ponosi sponsor badania. Pewnym jest to, że informacje uzyskane z wyników badań klinicznych mogą pomóc w przyszłości innym.
Należy jednak pamiętać, że testowanie substancji nowych niesie ze sobą pewne ryzyko. Jako lek niezarejestrowany, w fazie testów nie wiadomo jakie będzie jego działanie. Uczestnik narażony jest na nieznane do tej pory zdarzenia i działania niepożądane, wyniki leczenia i działania niepożądane mogą okazać się gorsze niż w terapii standardowej, może też dojść do znacznego pogorszenie stanu zdrowia. Można też znaleźć się w grupie kontrolnej nie przyjmującej badanej substancji. Może także spowodować zmniejszenie późniejszych opcji terapeutycznych. Udział w badaniach klinicznych leków może być czasochłonny, kłopotliwy, zwłaszcza, gdy nie mieszka się blisko miejsca, w którym prowadzone są badania. Może być uciążliwy dla osób, które pracują lub wychowują małe dzieci. Dla niektórych osób problemem może być też konieczność częstego pobierania krwi do badań.
Zasadą obowiązującą we wszystkich badaniach klinicznych jest ograniczenie udziału potencjalnego uczestnika tylko do jednego badania klinicznego w danym okresie. Dopiero po określonym czasie (3 - 6 miesięcy) od zakończenia aktualnego badania może on wziąć udział w kolejnym badaniu klinicznym. Jedynie lekarz prowadzący badanie (badacz) jest uprawniony do włączenia uczestnika do badania klinicznego i to on podejmuje ostateczną decyzję. Z naboru wyłączeni są potencjalni uczestnicy, którzy nie gwarantują ciągłości współpracy w trakcie trwania badania (częsty dojazd chorego do odległego ośrodka np. na wizyty kontrolne, badania diagnostyczne i zabiegi). Mając na uwadze bezpieczeństwo uczestników badania klinicznego oraz jednoznaczność i wiarygodność obserwacji w trakcie badania, dyskwalifikuje się również tych chorych, których leczenie należałoby wstrzymać bądź, którym leczenie mogłoby wręcz zaszkodzić.
Jeśli po dogłębnym zapoznaniu z tematem i przejściu naboru osoba nadal wyraża zainteresowanie uczestnictwem w badaniu powinna zgłosić się do odpowiedniego ośrodka badawczego.
Zależnie od częstości danej jednostki chorobowej i czasu przeznaczonego na rekrutację pacjentów ustala się liczbę ośrodków niezbędnych do przeprowadzenia badania. Badania można prowadzić w różnych krajach, uwzględniając aspekt jakości, kwalifikacji kadry medycznej, a także dostępności badanej grupy pacjentów. Badania można kontraktować w pojedynczych ośrodkach, lub korzystać z pomocy sieci zrzeszających sprawdzone ośrodki badawcze.
Najważniejszym dokumentem, który warunkuje przystąpienie do badania jest Świadoma Zgoda na Udział w Badaniu. Chroni dobro i bezpieczeństwo potencjalnego uczestnika w trakcie trwania badania klinicznego. Zgody udziela się w formie pisemnej na tak zwanym formularzu świadomej zgody. Dokument ten potwierdza, że potencjalny uczestnik dobrowolnie wyraża chęć wzięcia udziału w określonym badaniu, po zaznajomieniu się ze wszystkimi aspektami badania, które są istotne przy podejmowaniu decyzji o uczestnictwie. Są one zawarte w tak zwanej informacji dla uczestnika badania klinicznego. Aby uniknąć pominięcia jakiegokolwiek wymagania procesu świadomej zgody dość często informacja dla uczestnika badania klinicznego oraz formularz świadomej zgody występują razem w postaci wspólnego, zwartego dokumentu. ,, Świadoma zgoda wynika z potrzeby przestrzegania trzech kardynalnych, podstawowych zasad: szacunku dla osoby, dobroczynności i sprawiedliwości „- mówił Marek Czarkowski, dyrektor Ośrodka Bioetyki przy Naczelnej Radzie Lekarskiej, podczas jednej z konferencji poświęconych prowadzeniu badań klinicznych w Polsce.
Zgoda nie jest jednak kontraktem, a jedynie przyzwoleniem pacjenta na włączenie do badania, poddawanie się procedurom terapeutycznym zgodnie z wytycznymi z protokołu badania. Pacjent w każdej chwili może wycofać swoją zgodę bez podawania przyczyny i przerwać swój udział w badaniu bez żadnych konsekwencji. Pacjent zachowuje prawo do kontynuacji lub przerwania badania w trakcie jego trwania po otrzymaniu informacji o nowych odkryciach, bądź nowych zagrożeniach w prowadzonym badaniu.
Uczestnik badania klinicznego zapoznaje się z protokołem. Protokół badania jest przewodnim dokumentem każdego klinicznego projektu badawczego. Sporządzany jest przez grupę lekarzy lub innych badaczy, albo przez firmę farmaceutyczną. Po długiej fazie planowania, umieszcza się w nim istotne informacje dotyczące badania, cel i plan, a także opis metodyki i analizy statystycznej wraz z opisem planowanego przebiegu i warunków wykonania. W protokole badania zazwyczaj są przedstawione podstawy teoretyczne i uzasadnienie celowości jego przeprowadzenia.
Konieczność poprawienia protokołu badania zdarza się z przyczyn niezależnych od sponsora, np. przez zalecenia komisji bioetycznej, czy pojawiające się nowe dane naukowe. Często bywa skutkiem niewystarczającego dopracowania protokołu badania przez sponsora, np. nieuwzględnienia praktycznych warunków przeprowadzenia badania. Poprawianie protokołu w trakcie badania naraża sponsora na dodatkowe koszty, opóźnienie związane z koniecznością ponownego uzyskiwania opinii Komisji Bioetycznej i rejestracji przez właściwe władze, a także obniżenie jakości wyników związane z wprowadzonym zamieszaniem. Na podstawie protokołu badacze zbierają dane medyczne, które następnie wprowadzają do Kart Obserwacji Klinicznej.
Weryfikacją danych wprowadzonych na podstawie protokołu bezpośrednio w ośrodku zajmuje się monitor badań klinicznych. Monitor badań klinicznych (ang. Clinical Research Associate, CRA) to pracownik firmy sponsorującej badanie kliniczne lub jego przedstawiciel, którego głównym zadaniem jest monitorowanie badania. Jest odpowiedzialny za ocenę zgodności prowadzonego badania klinicznego z zasadami Dobrej Praktyki Klinicznej, zapewnienie przestrzegania protokołu badania, czuwanie nad bezpieczeństwem pacjentów uczestniczących w badaniu, wyjazdy monitorujące do ośrodków badawczych, weryfikowanie danych wpisanych do Karty Obserwacji Klinicznej z historią choroby pacjentów oraz rutynowymi kontaktami z zespołem badawczym każdego ośrodka uczestniczącego w badaniu. Jest to pierwsza osoba weryfikująca wiarygodność danych z badania.
Przed rozpoczęciem prac formułowana jest również tzw. broszura badacza. Jest ona dokumentem bardzo ważnym dla umiejętnego planowania badania klinicznego. Dokument ten powinien zawierać istotne informacje dotyczące badań podstawowych produktu, wyniki badań przedklinicznych (najniższa dawka toksyczna), informacje na temat sposobu monitorowania opracowane na podstawie wyników badań na zwierzętach. W miarę uzyskiwania danych z badań klinicznych uwzględnia się je w kolejnych edycjach Broszury Badacza, aby dokument zawierał najbardziej aktualne informacje.
Po znalezieniu sponsora badania, zebraniu grupy badaczy, uzyskaniu zgody Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych i innych instytucji oraz zebraniu grupy ochotników można przystąpić do przeprowadzenia badania klinicznego. W przypadku wielu leków badania kliniczne trwają 10 i więcej lat, zanim trafią do aptek.
Autor: Zuzanna Koperwas
- Rozporządzenie Ministra Zdrowia z dnia 2 maja 2012 r. w sprawie Dobrej Praktyki Klinicznej (Dz. U. z 2012 r. Nr 489).
- Badania kliniczne. Organizacja. Nadzór. Monitorowanie. Marcin Walter (red.). Warszawa: Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce, 2004. ISBN 8391913414.
- Marek Czarkowski Zagrożenie, ryzyko i szkoda w badaniach klinicznych Pol. Merk. Lek., 2008, XXV, 146, str. 105-106
- Norma ISO 14155 (2003-E):
- Część 1 (14155 – 1): Wymagania zasadnicze (26/02/2003)
- Część 2 (14155 – 2): Plan badania klinicznego (15/05/2003)
- Badania kliniczne w Polsce - Główne wyzwania, Listopad 2010
- Projektowanie badań biorównoważności oraz badań klinicznych I, II, III fazy, Teresa Brodniewicz, Marcin Ossowski, Podsumowanie szkolenia, Łódź 23.09.2008
- http://www.infarma.pl/uploads/media/Zasady_prowadzenia_badan_klinicznych.pdf
- http://www.badaniaklinicznewpolsce.pl/
- http://www.gcppl.org.pl/
- http://www.pmrpublications.com/press-releases/337/rynek-badan-klinicznych-w-polsce-rosnie-ale-wolno
- http://bio-etyka.blogspot.com/2010/12/raport-pwc-dotyczacy-badan-klinicznych_12.html\
- http://infarma.pl/fileadmin/badania_kliniczne_raport/Badania%20kliniczne%20w%20Polsce%202010.pdf
- http://www.urpl.gov.pl/pozwolenia-na-badania-kliniczne
- http://www.aids.gov.pl/files/wiedza/Badania_kliniczne.pdf
- http://www.astrazeneca.pl/513697/513073?itemId=13416663&nav=yes









Recenzje