- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Test kometkowy (Comet Assay, SCGE) – elektroforeza pojedynczych jąder komórkowych w żelu agarozowym
Comet assay zaliczan jest do metod o dużym potencjale poznawczym. Pozwala ona na badanie pojedynczych jąder komórkowych w żelu agarozowym, dzięki czemu możliwe jest badanie uszkodzeń DNA spowodowanych działaniem czynników genotoksyczności. Jako pierwsi , którzy podjęli się ocenie uszkodzeń DNA w pojedynczych komórkach byli Rydberg i Johanson (1978). Właściwa metoda testu kometkowego wprowadzona została przez Ӧstlinga i Johansona w 1984 roku. Test ten opiera się na badaniu komórek o różnym pochodzeniu, tak więc mogą to być komórki wątroby, krwi czy nabłonka. Najważneijsze jednak jest by komórki te zawierały jądro zawierające DNA [9].
Ekspozycja komórek na działanie endogennych i egzogennych czynników genotoksycznych powoduje, że dochodzi do modyfikacji chemicznych DNA. Działania te uważane są za potencjalne źródła mutacji w komórkach. W wyniku ekspozycji na te fizyczne lub chemiczne czynniki może dochodzić do modyfikacji struktury DNA, a dalej do uszkodzeń typu:
- jednoniciowe lub dwuniciowe pęknięcia DNA, które powstają w wyniku działania promieniowania jonizującego, leków przeciwnowotworowyc h lub działania wolnych rodników;
- powstawanie tzw. miejsc apurynowych i pirymidynowych, określanych jako miejsca AP,
- czy wiązania krzyżowego typu: DNA-DNA bądź DNA-białko.
Ze względu na fakt występowania różnorodnych uszkodzeń DNA, konieczne jest stosowanie różnych technik badawczych. I tak, do pomiaru poziomu jednoniciowych i dwuniciowych pęknięć DNA wykorzystuje się elektroforezę pojedynczych komórek, określaną mianem comet assay (ang. single cellgel electrophoresis, SCGE). Metoda ta służy również do identyfikacji wszelkich modyfikacji DNA możliwych do przekształcenia w pęknięcia na drodze chemicznej lub enzymatycznej [1].
Comet assay- zasada metody
Metoda polega na elektroforetycznym rozdziale jądrowego DNA, dzięki czemu możliwe jest obserwowanie fragmentacji DNA. W trakcie analizy badane komórki unieruchomiane są w żelu agarozowym. Jednak nie ma to nic wspólnego z tradycyjną elktroforezą, ponieważ w przypadku comet assay agaroza znajduje się na szkiełkach mikroskopowych. Tak przygotowane preparaty poddawane sa następnie lizie alkalicznej, co powoduje uwolnienie DNA z jądra komórkowego. Zastosowanie buforu lizującego o wysokiej sile jonowej wspomaga dysocjację białek od DNA. Po tym etapie przeprowadzana jest elektroforeza, która prowadzona jest w warunkach neutralnych, w standardowym buforze TBE, lub w warunkach alkalicznych. Po rozdziale, DNA poddaje się barwieniu fluorescencyjnemu lub solami srebra, a następnie analizuje się uzyskany obraz pod mikroskopem fluorescencyjnym [1], [3].
W trakcie analizy parametrem bezpośrednio mierzonym jest zmiana właściwości elektroforetycznych zmodyfikowanego kwasu nukleinowego (co obserwuje się w postaci wędrówki nici DNA w polu elektrycznym). Badane DNA w trakcie elektroforezy migruje w stronę anody z prędkością, która zależna jest od stopnia jego fragmentacji. Szybkość przemieszczania się badanych fragmentów w trakcie analizy jest proporcjonalna do stopnia fragmentacji. Ostatnim etapem comet assay jest analiza mikroskopowa, gdzie obraz mikroskopowy uszkodzonej komórki poddanej procedurze elektroforezy wyglądem przypomina kometę tj. „głowa” odpowiada miejscu, w którym unieruchomiono komórkę przed lizą, zaś „ogon” stanowią pętle i fragmenty nici DNA zrelaksowane i uwolnione ze struktur jądrowych w wyniku pęknięć- stąd też bierze się nazwa tej techniki [3].
Fluorochromy wykorzystywane w technice comet assay
Najczęściej wykorzystywanymi a zarazem najbardziej znanymi barwnikami używanymi w teście kometkowym są: bromek etydyny i SYBR Green. Stosowany jest także DAPI(4',6-Diamidino-2-phenylindole),jak również wszystkie inne barwniki, które wykazują powinowactwo do DNA [4].
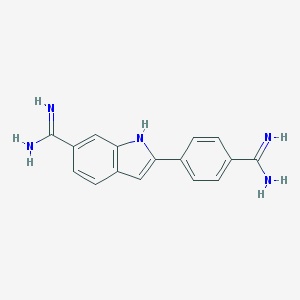
Zdjęcie: Wzór DAPI (C16H15N5) [7].
Przygotowanie barwników
Bromek etydyny:
Najczęściej wykorzystywany jest roztwór bromku etydyny o stężeniu 2µg/ml. Wykonuje się go ze stężonegp 10x roztworu roboczego (20µg/ml), który bezpośrednio przed użyciem rozcieńczany jest odpowiednio wodą. Barwnik ten emituje wysokie tło w analizie comet assay.
SYBR Green:
Przygotowywany jest w stosunku 10µl barwnika 1:100 z 90 µl 10 mM Trisu (o pH=7.5). Przed zmieszaniem odczynników, jako pierwszy w kolejności przygotowywany jest roztwór Sybr Green w DMSO(dimetylosulfotlenek) w stosunku: 1 µl stężonego barwnika z 99 µl DMSO. Tak przygotowany roztwór jest stabilny przez kilka godzin. Inną odmianą tego barwnika jest SYBR Gold, który przygotowywany jest w analogiczny sposób jak SYBR Green [1].
Znane są rónież inne metody wizualizacji, w tym np. barwienie praparatów z wykorzystaniem azotanu srebra, który pozwala na ich obserwcję w białym świetle [8].
Barwienie preparatów solami srebra (wg kucharczyk.com.pl):
- Szkiełka podstawowe z naniesionymi preparatami poddać 10 minutowej inkubacji w roztworze utrwalającym (od czasu do czasu zamieszać). Po upływie czasu inkubacji, preparaty przemyć za pomocą wody destylowanej, po czym wysuszyć w 37°C (cieplarka) przez co najmniej 1 godzinę,
- W tym czasie należy przygotować roztwór barwiący B (tj. 25 g węglanu sodu należy rozpuścić w 500 ml wody destylowanej), oraz roztwór C (tj. w 500 ml wody destylowanej należy rozpuścić kolejno: 100 mg azotanu amonu, 100 mg azotanu srebra, 500 mg kwasu wolframokrzemowego, a następnie dodać 0,25 ml 37% formaldehydu)
- Następnie, przed samym użycim połączyć 68ml roztworu barwiącego C z 32 ml roztworu barwiącego B. Przygotowaną mieszaniną zalać szkiełka i prowadzić barwienie przez 10 do 20 minut, aż do momentu uzyskania brązowego lub szarego koloru.
- Wybarwione szkiełka należy przemyć 2x za pomocą wody destylowanej, po czym zablokować reakcję barwienia przez zanurzenie szkiełek w 1% kwasie octowym. Na koniec szkiełka osuszyć. Tak przygotowane preparaty są gotowe do oglądania pod mikroskopem świetlnym [1].
Wykorzystanie comet assay
Metoda kometowa znalazła bardzo szerokie zastosowanie m.in. do: badania mechanizmów uszkadzania i naprawy DNA, określania genotoksyczności,a także w analizie uszkodzeń DNA powstałych in vivo . Ponadto, metodę wykorzystuje się w diagnostyce schorzeń, których bezpośrednią przyczyną są zaburzenia naprawy DNA [1].Znalazła także zastosowanie w cytologii, biochemii kwasów nukleinowych oraz immunologii, z powodzeniem stosowane jest również w farmakologii, medycynie(głównie onkologia, diagnostyka DNA). Comet assay w ochronie środowiska wykorzystywana jest do monitorowania występowania czynników fizycznych i chemicznych, które uszkadzają DNA w środowisku człowieka, zaś wprzemyśle spożywczym znalazła zastosowanie w kontroli stopnia napromieniowania żywności (w procesie sterylizacji radiacyjnej) [2].
Przygotowanie szkiełek podstawowych do analizy- wykonanie:
Każde używane szkiełko na samym początku należy poddać odtłuszczeniu. W tym celu należy je zanurzyć w roztworze acetonu ( chloroformu, etanolu lub metanol), po czym wysuszyć lub opalić na płomieniem. Następnie, w zlewce przygotować 1% roztwór agarozy NMP (zlewkę umieścić we wrzącej łaźni wodnej). W agarzoie zanurzać szkiełko, a po wyciągnięciu za pomocą bibuły należy zetrzeć nadmiar agarozy z dolnej powierzchni szkiełka, a tak przygotowe szkiełko pozostawić do wyschnięcia. Bardzo ważne na tym etapie jest, by zaznaczyć na której stronie szkiełka znajduje się agaroza, ponieważ po całkowitym wyschnięciu warstwa ta może być niewidoczna [1]. W celu większej oszczędności roztworu agarozy, zamiast zanurzania szkiełek, można na nie nanieść pipetą automatyczną 100 µl gorącej agarozy [1].
Utrwalanie i barwienie komórek:
Szkiełka z komórkami, bezpośrednio po etapie neutralizacji wybarwia się np. roztworem bromku etydyny w stężeniu 2 µg/ml. Na szkiełko nanosi się kroplę barwnika, po czym całość przykrywa się szkiełkiem nakrywkowym. Tak przygotowany preparat należy oglądać w mikroskopie fluorescencyjnym (z zastosowaniem odpowiedniego filtra). Ze względów praktycznych bardiej zalecane jest utrwalanie szkiełka w 96% alkoholu etylowym lub metanolu. Dzięki zastosowaniu tej metody utrwalania możliwe jest dłuższe przechowywanie preparatów. Przed samą analizą pod mikroskopem, szkiełka utrwalone w alkoholu wybarwia się z wykorzystaniem bromku etydyny (jak wyżej) [1].
Metoda elektroforezy kometkowej cieszy się bardzo dużą popularnością, ponieważ stosunkowo prosta i tania. Wraz z rozwojem technik badawczych, również comet assay doczekała się szerokiego wykorzystania- nie tylko w biologii molekularnej lecz również w medycynie, farmacji czy ochronie środowiska [4], [5].
Analiza obrazu kometek
Analiza prowadzona jest przez zliczanie komórek z danego zakresu wielkości ogona komety. Jednakże, najczęściej do analizy obrazu wykorzystuje się specjalistyczne oprogramowanie. Do opisu zaobserwowanych uszkodzeń w badanych preparatach stosuje się %DNA w ogonie lub "intensywność" ogona. Wykorzystywany jest także tzw.współczynniki Tail Moment (=długość_ogona*%DNA_ w_ ogonie/100) bądź „Olive Moment”. Oba współczynniki stosowane są do opisywania wzrostu uszkodzeń DNA do pewnego zakresu. Przekroczenie tego zakresu powoduje, że zwiększenie uszkodzeń nie ma wpływu na wzrostu wartości badanych współczynników [1],[2].
CometAssay® Starter Kits – postępowanie (zdjęcie poniżej)
- Komórki miesza się z agarozą o niskiej temperaturze topnienia
- Unieruchomienie komórek na płytce (CometsSlidesTM)
- Liza komórek w celu usunięcia DNA i związanych białek błonowych
- Potraktowanie próbek zasadą, w celu rozwinięcia („relaksacji”) i denaturacji DNA
- Rozdział elektroforetyczny w trakcie, którego uszkodzone, rozwinięte i „zrelaksowane” DNA migruje z komórki i może być zwizualizowane za pomocą barwienia z wykorzystaniem SybrGreen [6].
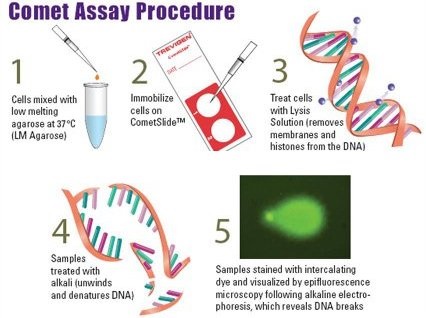
Zdjęcie: Comet assay, procedura wg AMS Biotechnology, CometAssay® Starter Kits, http://www.amsbio.com/Comet-Assays.aspx [6].
Promieniowanie jonizujące
Rozróżnia się dwa mechanizmy działania promieniowania jonizującego:
- Mechanizm bezpośredni (tzw. efekt tarczy)- polegający na uszkodzeniu najbardziej wrażliwych struktór komórkowych tj. DNA i błony komórkowej, poprzez działanie wolnych elektronów
- Mechanizm pośredni- jego wynikiem jest radioliza wody, spowodowany jest uszkodzeniem struktór komórkowych przez wolne rodniki [5].
Promieniowanie jonizujące jest wszechobecnym fizycznym czynnikiem, którego działanie na organizmy żywe powoduje uszkodzenia w DNA – jest to zjawisko powszechnie znane. W trakcie fizyko-chemicznych interakcji z komórkowym DNA dochodzi do powstawania wielu pierwotnych zmian, gdzie zazwyczaj rozróżnia się kilka typów uszkodzeń DNA:
- SSBs (single strand-breaks) - pojedynczoniciowe,
- DSBs (double strand-breaks) - podwójnoniciowe,
- wiązania krzyżowe DNA-DNA, DNA-białko,
- uszkodzenia purynowe i pirymidynowe [4], [5].
Test kometkowy pozwala na wykrycie uszkodzeń DNA oraz na badanie kinetyki naprawy DNA na poziomie pojedynczej komórki. Różnorodność możliwych modyfikacji tego testu ułatwia wykrywanie zarówno uszkodzeń typu SSBs, jak i DSBs, a także wiązań niestandardowych i wielu innych. Test kometkowy może być stosowany zarówno do dzielących się, jak i nie dzielących się komórek i komórek tkanek, które miały bezpośredni kontakt z czynnikiem genotoksycznym (środkiem genotoksyczności) [4].
W swoich badaniach Garaj-Vrhovac V. i Kopjar N (2002), wykorzystały metodę comet assay jako biomarker narażenia do oceny wpływu napromieniowania pracowników medycznych (50 osób), zawodowo narażonych na promieniowanie jonizujące. Jako kontrolę w swoich badaniach wykorzystały dane zaberane od 50 innych pracowników – nienarażonych na promieniowanie. Rodzaj uszkodzeń DNA badano przez pomiar stopnia migracji DNA w leukocytach krwi obwodowej (krew pobrana od grupy badanej i kontrolnej). Próbki krwi obwodowej od osób narażanych na promieniowanie i grupy kontrolnej pobrano przez nakłucie żyły do probówek zawierających heparynę. Alkaliczny test kometkowy przeprowadzono na pobranych próbach bezpośrednio po transporcie krwi.
Comet assay (procedura wg Garaj-Vrhovac V. i Kopjar N (2002))[4].
Test w przeprowadzonym badaniu prowadzono w warunkach zasadowych, opierając się na metodologii opisanej przez Singh i wsp. (1988).
Wykonanie:
Matowe szkiełko pokryto 1% agarozą (Sigma) o normalnej temperaturze topnienia (NMP), a po zestaleniu żel usunięto ze szkiełka. Następnie, szkiełko pokryto 0,6% agarozą NMP. Gdy warstwa ta się utrwaliła (zastygła), drugą warstwę zawierającą próbkę krwi zmieszano z 0,5% agarozą o niskiej temperaturze topnienia (LMP), po czym umieszczono na szkiełku. Po upływie 10 minut (zastyganie na lodzie) szkiełka pokryto 0,5% agarozą LMP.
Następnie, szkiełko zanurzono na 1 godzinę w świeżo przygotowanym lodowatym roztworze do lizy (tj.: 2,5M NaCl, 100mM Na2EDTA; 10mM Tris-HCl; 1% Na-sarcosinate (Sigma), pH 10); 1% Triton X-100; 10% sulfotlenek dimetylu). Dodany świeży odczyynik do próbki spowoduował lizę komórek i rozkład DNA. Po etapie lizy, szkiełko umieszczono w aparacie do elektroforezy poziomej od strony anody, napełnionym świeżym buforem do elektroforezy (tj.: 300 mM NaOH; 1mM Na2EDTA pH=13), a płytki umieszczono na 20 minut w buforze zasadowym, aby umożliwić odwijanie DNA. Proces denaturacji i elektroforezy prowadzono w temperaturze 4°C przy słabym świetle. Rozdział elektroforetyczny prowadzono przez 20 minut przy 25V [[4].
Po elektroforezie szkiełka delikatnie przepłukano (3x) w buforze do zobojetniania (tj.: 0,4M Tris-HCl o pH=7,5) w celu usunięcia nadmiaru zasady i detergentów. Każdy preparat wybarwiono bromkiem etydyny (o stężeniu 20µg/ml), po czym przykrywano je szkiełkiem nakrywkowym. Szkiełka przechowywano w temperaturze 4°C w zamkniętych pojemnikach, aż do momentu analizy [4].
Wyniki badań Garaj-Vrhovac V. i Kopjar N (2002)
Po analizie z wykorzystaniem comet assay, na podstawie otrzymanych wyników stwierdzono, że w grupie osób narażonych zawodowo na działanie promieniowania jonizującego (działanie z różną częstotliwością), znacząco wzrasta poziom uszkodzeń DNA, w porównaniu do grupy kontrolnej [4].
Rozdział elektroforetyczny preparatów (procedura wg Brzuzan P. i wsp. (2007)):
- Do probówek zawierających badane komórki należy dodać po 65µl rozgrzanej 0,5% agarozy LMP, całość dokładnie wymieszać przez pipetowanie
- Mieszaninę agarozy LMP z komórkami nałożyć na szkiełko podstawowe, pokryte 1% agarozą, po czym schłodzić je na płytce z lodem
- Po upływie czasu chłodzenia, należy ponownie nałożyć na szkiełko (drugą warstwę) agarozy LMP, po czym czynność tą powtórzyć trzeci raz
- Tak przygotowane preparaty umieścić w kominku wypełnionym odpowiednim buforem lizującym (1h).
- Po upływie czasu lizy, preparaty umieścić w aparacie do elektroforezy (preparaty zalać buforem i pozostawić na 20 minut),następnie prowadzić rozdział elektroforetyczny przez 15 minut,
- Rozdzielone elektroforetycznie preparaty poddać neutralizacji: w tym celu przenieś je na kratkę i neutralizować, polewając każde szkiełko 3x buforem w odstępach 5-minutowych. Jako neutralizator wykorzystać np. 0,4 Tris o pH=7.5
- Tak przygotowane preparaty poddaje się następnie barwieniu za pomocą bromku etydyny ( w stężeniu 20µl/ml). Na każde szkiełko nanosi się 50uL bromku, po czym nakrywa szkiełkiem nakrywkowym. Tak przygotowane preparaty są gotowe do analizy (analiza mikroskopowa) [8].
Bufor elektroforetyczny (alkaliczny):
- 300 mM NaOH (12g/L)
- 1 mM EDTA (0,371 g/L)
- ustalić pH >13 [1]
Ważne, by do zakończenia rozdziału elektroforetycznego wszystkie czynności prowadzone były przy przyciemnionym świetle , ponieważ intensywne światło powoduje uszkodzenia DNA [1].
Autor: Lidia Koperwas
Literatura:
[1]. http://www.kucharczyk.com.pl/instrukcje/poradykometa.pdf . Dr Marcin Schmidt, Uniwersytet Przyrodniczy w Poznaniu, http://www.up.poznan.pl/~mschmidt/
[2]. http://www.kucharczyk.com.pl/
[3]. Shaposhnikov S.A. , Salenko V.B., Brunborg G., Nygren J.,Collins A.R., 2008. Single-cell gel electrophoresis (the comet assay): Loops or fragments? ELECTROPHORESIS Volume 29, Issue 14, pages 3005–3012, No. 14 July 2008, (abstract). http://onlinelibrary.wiley.com/doi/10.1002/elps.200700921/abstract;jsessionid=3C8F2CE80444FC705895101756E003C6.f04t04
[4], Garaj-Vrhovac V., Kopjar N., 2002. The alkaline Comet assay as biomarker in assessment of DNA damage in medical personnel occupationally exposed to ionizing radiation. • Oxford Journals Life Sciences & Medicine Mutagenesis Volume 18, Issue 3 Pp. 265-271. http://mutage.oxfordjournals.org/content/18/3/265.full
[5]. Podstawy radioterapii nowotworów, sytuacje szczególne w leczeniu nowotworów. http://e-onkologia.am.wroc.pl/docs/PODSTAWY_RADIOTERAPII_SYTUACJE%20SZCZEGOLNE%20W%20LECZENIU%20NPL_WF.pdf
[6]. Standardised DNA Damage quantitation with the CometAssay® Electrophoresis System,AMS Biotechnology, http://www.amsbio.com/Comet-Assays.aspx
[7]. http://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=2954
[8].Brzuzan P., Woźny M., Łuczyński M.K., 2007. Toksykologia molekularna, przewodnik do ćwiczeń, Olsztyn 2001. http://biotechnology.keyland.biz/pdf/tox_mol_updated.pdf
[9]. Jurczyk Ł., Lewandowska R., Brzuzan P., Woźnicki P., 2003. Zastosowanie metody kometowej w wykrywaniu genotoksyczności substancji chemicznych u ryb. Komunikaty Rybackie, 5/2003. http://pracownicy.uwm.edu.pl/brzuzan/files/poz_19_Other_papers_Zastosowanie_metody_kometowej.pdf









Recenzje