- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Rozdzielanie składników krwi przez wirowanie w gradiencie gęstości
Krew jest ciekłą tkanką, w skład której wchodzą elementy upostaciowione tj.: krwinki czerwone, krwinki białe i płytki krwi. Elementy te zawieszone są w części płynnej określanej mianem osocza lub plazmy. Osocze stanowi 55% , zaś elementy morfotyczne 45% objętości krwi. W momencie, gdy osocze zostanie pozbawione fibrynogenu, określa się je mianem surowicy krwi [3].
Krew krąży w zamkniętym układzie naczyń krwionośnych. Zawiera ona elementy morfotyczne tj. czerwone i białe krwinki oraz płytki krwi, które zawieszone są w płynnym środowisku osocza. Krew, a w szczególności osocze spełnia wiele ważnych funkcji, które są niezwykle istotne dla zachowania zdrowia. Surowica to faza płynna krwi, która powstaje po jej skrzepnięciu. Surowica w swoim składzie nie zawiera czynników krzepnięcia, w tym fibrynogenu, które prawidłowo występują w osoczu, lecz zużywają się podczas procesu krzepnięcia krwi. Surowica zawiera pewne produkty degradacji czynników krzepnięcia, które powstają w tym procesie, a zwykle nie występują w osoczu [2].
Krew spełni a wiele ważnych funkcji w organizmie, odpowiada m.in. za:
- Oddychanie (transport tlenu z płuc do tkanek oraz dwutlenku węgla z tkanek do płuc)
- Odżywianie (transport wchłoniętych substancji odżywczych)
- Wydalanie (transport zbędnych metabolitów do nerek, płuc, skóry i jelit w celu ichusunięcia)
- Utrzymywanie prawidłowej równowagi kwasowo-zasadowej w organizmie
- Regulację gospodarki wodnej
- Regulację temperatury ustrojowej poprzez dystrybucję energii cieplnej w organizmie
- Obronę przed zakażeniem za pośrednictwem białych krwinek i krążących przeciwciał
- Transport hormonów i regulację metabolizmu
- Transport metabolitów
- Krzepnięcie [2], [3],[8].
W skład osocza wchodzi woda, elektrolity, metabolity, składniki pokarmowe, białka i hormony. Co więcej, zawartość wody i elektrolitów w osoczu jest praktycznie taka sama jak we wszystkich płynach pozakomórkowych. Oznaczanie stężenia Na, K, Ca i Cl w surowicy oraz ciśnienia cząstkowego dwutlenku węgla i pH krwi, są niezwykle ważne w procesie leczenia wielu chorób [2].
Tak więc, komórki krwi są intensywnie badane, ponieważ można je łatwo uzyskać. Ponadto, pełnią one liczne funkcje biologiczne, a także biorą udział wwielu procesach chorobowych, w związku z tym określanie składu krwi ma niezwykle ważne znaczenie w diagnostyce [2].
Krwinki czerwone (erytrocyty) – RBC
Erytrocyty są to komórki krwi charakteryzujące się dyskowatym, dwuwklęsłym kształtem. Komórki te odgrywają bardzo istotną rolę w organizmie, tj.: transportują niezbędny do życia tlen z płuc do wszystkich tkanek, a także dwutlenek węgla z tkanek do płuc , co ma na celu jego wydalenie do powietrza atmosferycznego. Do produkcji erytrocytów (zachodzącej w szpiku kostnym) niezbędny jest szereg mikro- i makroelementów, wśród których najważniejsze są: żelazo, witamina B12 i kwas foliowy. Czas życia pojedynczego erytrocytu wynosi 120 dni, po jego upływie erytrocyt niszczony jest w układzie siateczkowo-śródbłonkowym, znajdującym się w śledzionie i wątrobie [4].
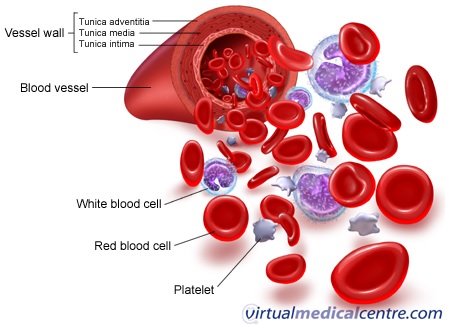
Zdjęcie: Elementy morfotyczne krwi, http://www.myvmc.com/anatomy/blood-function-and-composition/ [5].
Leukocyty - białe krwinki krwi
Leukocyty są komórkami krwi stanowiącymi składową układu odpornościowego. Biorą one udział w walce z patogenami, takimi jak wirusy i bakterie. Czas ich życia waha się od kilku dni do nawet 20 lat [4]. Zwiększenie całkowitej liczby leukocytów najczęściej spowodowane jest zakażeniem organizmu, w wyniku którego dochodzi do uwalniania młodych form leukocytów ze szpiku kostnego do krwi, by skuteczniej zwalczać dany patogen. Liczba uwolnionych leukocytów może dochodzić do 20 000/µl [4]. Leukocyty dodatkowo dzieli się na dwie podkategorie: granulocyty oraz agranulocyty. Wśród granulocytów wyróżnia się neutrofile, eozynofile oraz bazofile, zaś agranulocytów: limfocyty i monocyty [5].
Unikalna struktura krwi daje możliwośc bardzo łatwego oddzielenia czerwonych krwinek od osocza i innych elementów przez wirowanie. Po wyizolowaniu, czerwone krwinki mogą być poddane lizie (pękaniu) przez zawieszenie w hipotonicznym medium. W wyniku osmozy, krwinki pobieraja wodę, w wyniku czego pęcznieją i eksplodują, pozostawiając pusty worek membranowy [8]. W przypadku, gdy z próbki krwi chcemy odzyskać surowicę, krew należy potraktować antykoagulantem. Do przemywania krwinek czerwonych wykorzystuje się odpowiedni bufor, w skład którego zazwyczaj wchodzi 0,9% NaCl z dodatkiem 5 mM fosforanu sodu, pH=8. Odpowiedni bufor hipotoniczny używany do lizy krwinek czerwonych składa się z 5 mM fosforanu sodu o pH=8, bez dodatku NaCl. Można również wykorzystać samą wodę destylowana , jednakże wtedy nie mamy kontroli nad pH. Jeżeli procedura izolacji prowadzona jest na lodzie i zachodzi szybko, nie jest konieczne używanie środka konserwującego [9].
Przeprowadzone badania potwierdziły, że dobre wyniki izolacji czerwonych krwinek można uzyskać poprzez bezpośrednie frakcjonowanie próbki w probówce wirówkowej, z dodatkiem potrójnej objętości buforu w stosunku do objetości próbki. Tak więc, w momencie dysponowania 3 ml krwi, do próbki należy dodać 9 ml buforu izotonicznego. W przypadku tkanek stałych na jeden gram tkanki należy dodawać 1 ml buforu. Straty w wyniku frakcjonowania tkanek stałych wynikają z niepełnego rozdzielana składników, materiałów wystających z powierzchni oraz płynów pozostałych po transferze. Mniejsza końcowa objętość osadu jest często wynikiem utraty materiału w trakcie ścierania [9].
Bufor, który jest uważany za izotoniczny w odniesieniu do typu komórek ma taką samą osmolarność jak środowisko, w którym komórki są zazwyczaj zawieszone. Zatem, komórki ani nie pęcznieją ani nie kurczą się w tym buforze. Głównym elektrolitem w osoczu krwi, podobnie jak i w płynie śródmiąższowym u kręgowców jest chlorek sodu, tak więć logicznym wyborem w buforze izotonicznym jest 0,9% NaCl. W trakcie wykonywania procedury, konieczne jest dokładne wymieszanie próbki z buforem przed samym rozpoczęciem procesu przemywania czerwonych krwinek wolnych od białek osocza. Bardzo skutecznym sposobem mieszania jest ucieranie próbki (wielokrotne zaciąganie cieczy do pipety i natychmiastowe jest usuwanie- trzymając końcówkę pipety ciagle zanurzoną). Tak przygotowana próbka powinna być zwirowana natychmiast po roztarciu. Odwirowane komórki oddzielają się w postaci osadu od większości białek osocza, które ulegają rozpuszczeniu i pozostają w supernatancie. Peletki komórkowe po wirowaniu zazwyczaj nie są szczelnie upakowane w probówce, w związku z czym zaleca się ich płukanie, by usunąć pozostałości białek osocza z próbki [9].
Wirowanie już z prędkością 600 x g powoduje szybkie opadanie krwinek czerwonych. Działa na nie nawet niska prędkość wirowania, gdyż komórki te są mocno wypełnione hemoglobiną. 10-minutowe wirowanie jest wystarczające aby oddzielić peletkę czerwonych krwinek od rozcieńczonego supernatantu osocza. Otrzymany osad powinien być ponownie zawieszony w buforze izotonicznym przez roztarcie, a następnie ponownie zwirowany (tzw. etap przemywania).
Aby procedura frakcjonowania krwinek czerwonych była jak najbardziej efektywna,w trakcie jej przeprowadzania należy przestrzegać kilku zasad. Przy braku doświadczenia we frakcjonowaniu krwi, próbki należy trzymać na lodzie. Próbki należy trzymać w taki sposób, by dodatkowo nie ogrzewać ich dłońmi, a także należy unikać zanieczyszczenia buforów używanych w trakcie pracy- najlepiej pracować na małych objętościach buforów. Celem etapu płukania jest uwolnienie poszczególnych składników zanieczyszczających substancje rozpuszczone, jeżeli na tym etapie w próbce pozostają jakieś nierozpuszczone kawałki osadu, etap przemywania jest nieskuteczny. Każdorazowo osad musi być całkowicie rozproszony w próbce [9].
Izolacja erytrocytów (wg Hanson M.S. i wsp., 2008)
Bufor do przemywania komórek: 21,0 mM Tris, 4,7 mM KCl, 2mM CaCl2, 140,5 mM NaCl, 1,2 mM MgSO4 , 5,5mM glukozę oraz 0,5% albuminę bydlęcą frakcji V, końcowe pH=7.4 [7].
Wykonanie:
- Próbkę pełnej krwi zwirować przy 500 x g, przez 10 minut w 4°C.
- Zassać powstały supernatant (osocze, kożuszek )- odrzucić. Do otrzymanego osadu erytrocytów dodać bufor do przemywania komórek (dodać podwójną ilośc buforu w stosunku do objętości erytrocytów).
- Ponownie zwirować próbkę (jak wyżej), a po wirowaniu znów dodać bufor do przemywania komórek
- Etap 2 i 3 należy powtórzyć 2x- w sumie przeprowadzić trzy płukania erytrocytów. Otrzymane erytrocyty ni emogą być przechowywane na lodzie- dobrze znoszą temperaturę pokojową przez 4 do 5 godzin. Dalsze badania na otrzymanych erytrocytach nie muszą być wykonywane w dniu izolacji [7].
Rozdzielanie elementów krwi przez wirowanie w gradiencie gęstości
Elementy krwi moga być oddzielone od osocza podczas kilkuminutowego wirowania w specjalnej probówce, służącej do rozdzielania składników krwi w zależności od ich gęstości. By rozdzielić elementy krwi, próbkę poddaje się wirowaniu przy 3000 obr./minutę (bądź większych). Dochodzi do rozdzielenia faz pod wpływem działania siły odśrodkowej, w wyniku której na samej górze pozostaje osocze [5], [6].
Erytrocyty są gęstsze niż osocze, w związku z czym podczas wirowania opadają na samo dno probówki wirówkowej, stanowiąc ok. 45% całkowitej jej objętości. Leukocyty i płytki krwi tworzą tzw. kożuszek (kremowego koloru płaszcz znajdujący się tuż nad warstwą erytrocytów). Osocze (plazma) po wirowaniu występuje nas kożuszkiem w postaci jasno-żółtej warstwy, stanowiąc nieco poniżej 55% ogólnej objętości próbki [5].
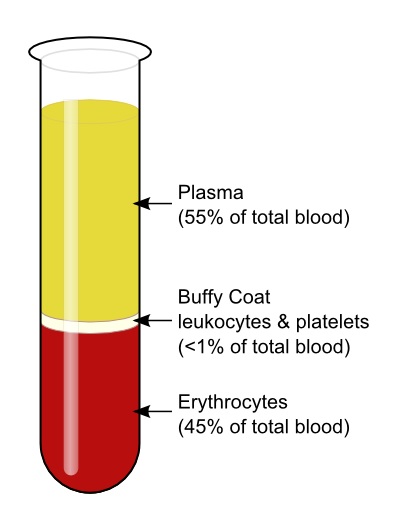
Zdjęcie: Frakcje krwi po wirowaniu, https://www.boundless.com/biology/the-circulatory-system/components-of-the-blood/plasma-and-serum/
Płytki krwi - trombocyty
Płytki krwi, czyli trombocyty, są komórkami biorącymi udział w procesie krzepnięciu krwi. W miejscu krwawienia, wraz z białkiem o nazwie fibryna, płytki krwi tworzą rodzaj siateczki, która zapobiega nadmiernej utracie krwi. Przyjmuje się, że wystarczającą wartością pozwalającą na sprawne działanie układu krzepnięcia jest 50 000/µl. Zmniejszona liczba płytek jest częstym zjawiskiem obserwowanym po długim czasie od pobrania krwi do jej analizy, jednakże stan ten może byc również związany z niedoborem witaminy B12 i kwasu foliowego, bądź uszkodzeniem miejsca produkcji, czyli szpiku kostnego [4].
Krew w badaniach
Do badań krwi wykorzystuje się tzw. krew pełną, zawierającą wszystkie składniki płynne i morfotyczne, jak również surowicę i osocze. W zależności od tego jakie badania będą wykonywane , krew pobierana jest do probówek z antykoagulantem (tj. związkiem zapobiegającym powstawanie skrzepu i umożliwiającym oddzielenie surowicy), bądź też do probówek zawierających określony związek przyśpieszający lub hamujący wykrzepianie. Stosowanie antykoagulanów zapobiega wykrzepianiu, dzięki czemu możliwe jest wykonywanie badań w pełnej krwi lub osoczu po odwirowaniu krwi w określonym czasie i warunkach (tj. w odpowiedniej temperaturze, ilości obrotów). Oddzielenie surowicy i osocza należy przeprowadzać w czasie nie dłuższym niż do 1 godziny od momentu pobrania próbki krwi [1].
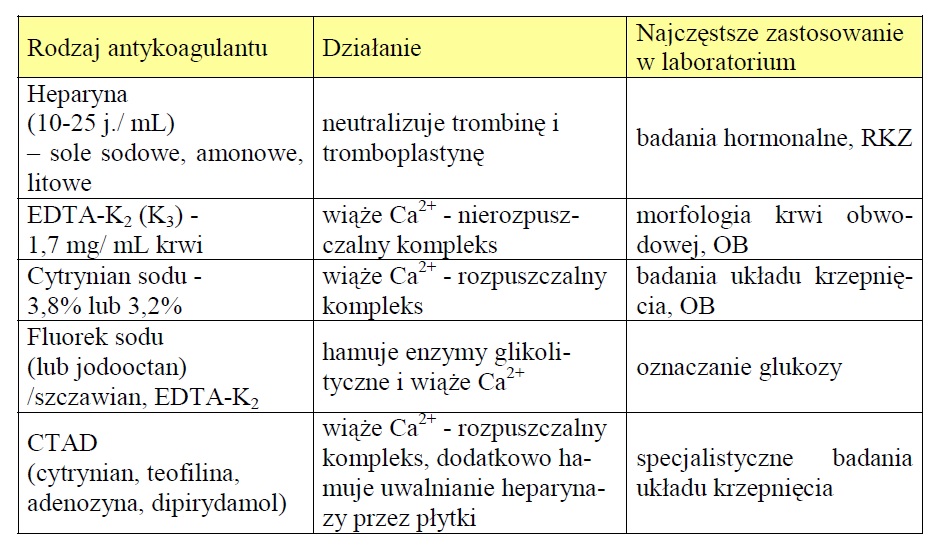
Zdjęcie: Rodzaje środków przeciwkrzepliwych stosowanych w laboratoriach (Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I), [1].
W przypadku badań biochemicznych najczęściej wykorzystuje się surowicę lub osocze- rzadziej jest to pełna krew. W badaniach koagulologicznych próbke stanowi osocze krwi pobrane do probówek zawierających roztwór cytrynianu. Próbka najczęściej przygotowywana jest w następujący sposób: 9 objętości krwi + 1 objętość cytrynianu. W przypadku badani aOB (odczyn Biernackiego), pobiera się krew pełną do probówek zawierających roztwór cytrynianu (w stosunku: 4 obj. krwi + 1 obj. cytrynianu) lub EDTA-K2 [1].
Hemoliza krwi
Krwinki czerwone posiadają otoczkę zbudowaną głównie z połączeń białkowo-lipidowych. Otoczka ta pełni funkcję błony półprzepuszczalnej , warunkując tym samym zjawisko osmozy. Błona przepuszcza wodę, aniony, mocznik oraz glukozę, z kolei dla kationów (Na+ oraz K+) jest nieprzepuszczalna. Błona białkowo-lipidowa oddzielająca wnętrze erytrocytów od otoczenia, jest jedyną barierą jaką posiadają te komórki od czynników środowiskowych. Pod wpływem tych czynników błona erytrocytów ulega modyfikacjom, m.in. przez zmianę kształtu komórek [3], [10]. Zdolność czerwonych krwinek do odkształceń w dużej mierze zależy od składu błony komórkowej. Największe znaczenie mają jednak zmiany ilościowe cholesterolu i fosfolipidów w błonach. W trakcie badań zaobserwowano, że wzrost stężenia cholesterolu nadaje sztywność błonie komórkowej [11]. Tak więc, zaburzenia w rozkładzie fosfolipidów błonowych odpowiadają za zmiany kształtu erytrocytów. Główne fosfolipidy występujące w błonie krwinek czerwonych to: fosfatydylocholina (PC), sfingomielina (SM), fosfatydyloseryna (PS), fosfatydyloetanoloamina (PE), fosfatydyloinozytol (PI) oraz kwas fosfatydowy [11].
W roztworze izotonicznym z osoczem, krwinki czerwone nie ulegają zmianom na poziomie morfologicznym. Jak wspomnino wcześniej, najczęściej wykorzystywanym roztworem izotonicznym jest 0,9% roztwór wodny NaCl tj. roztwór fizjologiczny soli. Inny roztwór, zwany hipertonicznym, powoduje kurczenie się krwinek, na skutek przejścia wody z krwinki do roztworu hipertonicznego. Zjawisko to zachodzi w myśl prawa osmozy. Odwrotny efek daje z kolei tzw. roztwór hipotoniczny, w którym to krwinki czerwone ulegają pęcznieniu. Dzieje się to na skutek przejścia wody z roztworu do krwinki. W momencie, gdy różnica ciśnienia osmotycznego między roztworem a erytrocytami przekroczy granice oporności krwinki, dochodzi do pęknięcia krwinki w wyniku czego zawarta w niej hemoglobina wylewa się do otaczającego roztworu. Zjawisko to określane jest mianem hemolizy krwi. Prawidłowo wykształcone krwinki czerwone ulegają hemolizie w wodnych roztworach NaCl o stężeniu w granicach 0,45 (oporność minimalna) do 0,32% (oporność maksymalna). W granicy oporności maksymalnej dochodzi do zhemolizowania wszystkich krwinek [3]. Przy użyciu środków chemicznych takich jak: aceton czy eter, możliwe jest wywołanie hemolizy krwi w roztworach izotonicznych. Związki te powodują rozpuszczanie skłądników otoczki krwinek (lipidy, cholesterol) bądź też wchodzą w reakcję z tymi związkami, powodując zanik półprzepuszczalnych właściwości otoczki. Rónież zamrożenie krwi powuje jej hemolizę, co wywołane jest zamarzaniem wody w krwince [3].
Sam proces hemolizy nie jest pożądanym zjawiskiem, ponieważ powoduje utratę niektórych oznaczeń laboratoryjnych. Obecność hemolizy w umiarkowanym lub większym stopniu wpływa niekorzystnie na próbki krwi na różne sposoby. W trakcie hemolizy uwalniana jest zawartość erytrocytów (potas, dehydrogenaza mleczanowa) podnosząc w ten sposób stężenia surowicy.
Ponadto, uwolniona hemoglobina nadaje kolor osoczu krwi i surowicy, co zakłóca oznaczenia kolorymetryczne, zwłaszcza pomiary fotometryczne przy użyciu krótkich fal światła widzialnego [12].
Wśród najczęściej pojawiających się przyczyn hemolizy wyróżnia się:
1)Zbieranie krwi: należy podjąć wszelkie działania w celu uniknięcia nadmiernego- długotrwałego opaski uciskowej w trakcie pobierani akrwi. Malsymalnie powinno się ją używać przez 2 minuty, gdyż łączny efekt podwyższonego ciśnienia dożylnego i niedotlenienia powoduje utrudnienie w przejściu erytrocytów, białek osocza i innych dużych cząsteczek przez ścianę żył, powodując wzrost ich stężenia [12].
2)Transfer krwi: usuwanie pobranej krwi ze strzykawki przez igłę może doprowadzić do hemolizy. Używanie dużych igieł pomaga zapobiec hemolizie krwi i utrzymuje integralność próbki. Ponadto, pobranej krwi nie należy wstrząsać w pojemniku, a po dodaniu antykoagulantów próbke należy delikatnie wymieszać- pojawienie się speinienia w próbce jest oznaką hemolizy. Mieszanie krwi nie zawierającej antykoagulanta powoduje natychmiastową hemolizę [12].
3)Ekstremalne temperatury: gorące lub zimne mogą powodować hemolizę [12].
Autor: Lidia Koperwas
Literatura:
[1]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska, s. 13-14.
[2]. Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W., 1995. Biochemia Harpera,Wydanie III. Redaktor naukowy tłumaczenia Franciszek Kokot . Wydawnictwo Lekarskie PZWL. Rozdział 58: Białka osocza, immunoglobuliny i czynniki krzepnięcia, Elizabeth J. Harfenist, Robert K. Murray, s. 770- 771.
[3]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.576-580.
[4]. http://www.mp.pl/pacjent/badania_zabiegi/show.html?id=99884
[5]. http://www.myvmc.com/anatomy/blood-function-and-composition/
[6].https://www.boundless.com/biology/the-circulatory-system/components-of-the-blood/plasma-and-serum/
[7]. Hanson M.S., Stephenson A.H., Bowles E.A., Sridharan M., Adderley S., Sprague R.S., 2008. Phosphodiesterase 3 is present in rabbit and human erythrocytes and its inhibition potentiates iloprost-induced increases in cAMP. Am.J.Physiol Heart Circ.Physiol 2008;295:H786-H793, http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2519193/
[8]. Poomcokrak J., Neatpisarnvanit C.,2008. ]. RED BLOOD CELLS EXTRACTION AND COUNTING Department of Biomedical Engineering, Mahidol University, Thailand Department of Electrical Engineering, Mahidol University, Thailand. The 3rd International Symposium on Biomedical Engineering (ISBME 2008). http://www.kmitl.ac.th/ijabme/proceedings/bmeicon08/pdf/Session4/1105.pdf
[9]. Caprette D.R. , 2012. Blood and Erythrocyte Fractionation. Experimental Biosciences, Resources for Introductory & intermediate level laboratory courses. http://www.ruf.rice.edu/~bioslabs/studies/sds-page/gellab1.html
[10]. Stasiuk M., Kijanka G., Kozubek A., 2009. Zmiany kształtu erytrocytów i czynniki je wywołujące. Postępy Biochemii 55 (4) 2009. http://www.google.pl/url?sa=t&rct=j&q=&esrc=s&source=web&cd=3&ved=0CDgQFjAC&url=http%3A%2F%2Fwww.researchgate.net%2Fprofile%2FArkadiusz_Kozubek%2Fpublication%2F41758888_Transformations_of_erythrocytes_shape_and_its_regulation%2Ffile%2Fd912f50b48a6c5535b.pdf&ei=QlSLU9jsAsjb7AbFsIGAAg&usg=AFQjCNGj1Zu5IJ_dZHvYtfCkj9InvO44TA&bvm=bv.67720277,d.ZGU
[11]. Witkowska J., Bober J., Chlubek D., 2007. Zmiany składu lipidowego błon erytrocytów osób z przewlekłą niewydolnością nerek. A N N A L E S A C A D E M I A E M E D I C A E S T E T I N E N S I S R O C Z N I K I P O M O R S K I E J A K A D E M I I M E D Y C Z N E J W S Z C Z E C I N I E, 2007, 53, 2, 46–51. http://www.pum.edu.pl/__data/assets/pdf_file/0010/13303/3479_7.pdf
[12]. William M. Mitchell, Hemolysis- cause and effect. MD Vanderbilt University Medical Center. http://www.hhla.com/docs/hemolysis.pdf









Recenzje