- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Wpływ wektorów bakteryjnych na postęp w przemyśle biotechnologicznym
Wektorami stosowanymi w biotechnologii są różnego rodzaju nośniki DNA zdolne do wnikania i autonomicznej replikacji w danym rodzaju komórek. Zapewniają one ochronę i powielanie wprowadzonego fragmentu DNA oraz umożliwiają ekspresję zawartych w nim genów. Istnieje kilka typów wektorów, a dobranie właściwego zależy głównie od tego, w jakiej komórce dany gen będzie klonowany. W przemyśle biotechnologicznym wektory są wykorzystywane przede wszystkim do klonowania oraz tworzenia bibliotek genowych różnych organizmów. Ponadto odgrywają one istotną rolę podczas przenoszenia DNA pomiędzy różnymi organizmami, co pozwala na produkcję różnego rodzaju białek w organizmach, które normalnie ich nie wytwarzają. Istotne znaczenie mają tu białka o znaczeniu terapeutycznym [1].
Charakterystyka wektorów
Wektor jest to cząsteczka DNA, która służy do wprowadzenia obcego materiału genetycznego do komórki gospodarza. Wektor, w którym umieszczono krótki fragment DNA, zawierający badaną sekwencję lub gen, nazywany jest rekombinowanym DNA. Wektory powinny posiadać kilka podstawowych cech. Po pierwsze żaden wektor nie powinien zakłócać funkcji życiowych komórek gospodarza. Natomiast powinien posiadać miejsca restrykcyjne umożliwiające odpowiednie wstawienie fragmentu DNA oraz być zdolny do autonomicznej replikacji w swoistym gospodarzu. Wektor powinien także posiadać gen markerowy, który jest odpowiedzialny za odróżnienie komórek gospodarza, które pobrały zrekombinowany wektor, od tych, które go nie pobrały. Istotne znaczenie ma także pojemność wektora, która decyduje o wielkości wprowadzanego DNA. Obecnie znanych jest wiele wektorów o różnych właściwościach, takich jak zakres gospodarza, miejsca rozpoznawane przez enzymy restrykcyjne, ilość i typ genów markerowych, wielkość fragmentu DNA niesionego przez wektor czy liczba kopii plazmidu. Wektory są powszechnie stosowane w biotechnologii jako narzędzie inżynierii genetycznej. Wyróżnia się wektory ekspresyjne, klonujące oraz bifunkcjonalne. Wektory ekspresyjne odpowiadają za ekspresję wprowadzanych genów lub ich integrację z materiałem genetycznym gospodarza. Wektory klonujące zawierają charakterystyczne geny, które umożliwiają polimerazie DNA rozpoczęcie replikacji, powodując namnażanie w dużych ilościach wprowadzanego materiału genetycznego (klonowanie). Natomiast wektory bifunkcjonalne zwane także wahadłowymi mogą egzystować w minimum dwóch różnych organizmach. Wektory są wykorzystywane przede wszystkim do klonowania i amplifikacji sekwencji DNA, badania mechanizmów ekspresji DNA oraz wprowadzania genów do komórek bakteryjnych (transformacja) i zwierzęcych (transfekcja) [1].
Zastosowanie wektorów bakteryjnych do klonowania
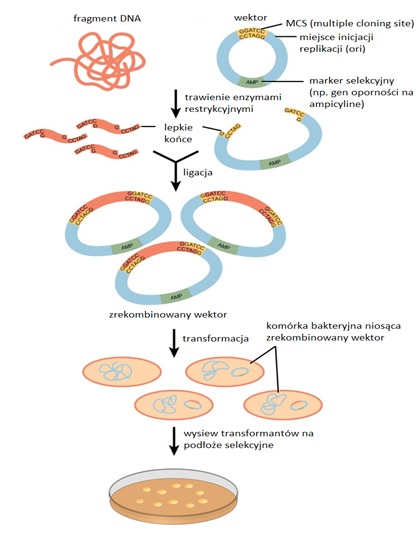
Rys 1. Ogólny schemat klonowania molekularnego.
Do klonowania stosowane są głównie wektory plazmidowe. Dobry wektor powinien posiadać odpowiednie elementy funkcjonalne, takie jak systemy replikacyjne, geny markerowe, unikalne miejsca restrykcyjne oraz co najmniej jeden silny promotor. Systemy replikacyjne zawierają miejsce inicjacji replikacji (ori) oraz w większości wektorów gen rep, który koduje białko inicjujące replikację. Sposób regulacji inicjacji replikacji decyduje o liczbie kopii plazmidu w komórce, dlatego wyróżniamy wektory wysoko- i niskokopijne. Wektor jest również zaopatrzony w geny markerowe, czyli geny kodujące białka odpowiedzialne za łatwo wyróżnialne cechy fenotypowe. Każdy wektor powinien zawierać co najmniej jeden marker selekcyjny (np. gen oporności na antybiotyk), który umożliwia identyfikacje komórek zawierających dany wektor. Istotne znaczenie mają także unikalne miejsca restrykcyjne, które służą do wprowadzania obcego DNA. W wektorach nowej generacji taką funkcję pełni tzw. polilinker (ang. Multiple Cloning Sites - MCS), syntetyczny nukleotyd rozpoznawany przez różne enzymy restrykcyjne. Ponadto w strukturę wektora wprowadza się silny promotor warunkujący wysoką ekspresję danego genu [3].
Jednym z pierwszych poznanych i zarazem często wykorzystywanych wektorów bakteryjnych jest plazmid pBR322. Jest to niewielki plazmid o długości 4366 pz, do którego można wstawiać fragmenty DNA do 10 kpz. Zawiera on miejsce inicjacji replikacji (ori), które pozwala na replikację w jedynym gospodarzu - Escherichia coli. pBR322 jest stabilnym plazmidem, normalnie występującym w ilości 20-30 kopii na komórkę. Zawiera on geny oporności na dwa antybiotyki: ampicylinę i tetracyklinę. Plazmid pBR322 jest prekursorem wielu wektorów. Konstrukcja nowych wektorów poszła w kierunku dodania nowych miejsc umożliwiających klonowanie (MCS –Multiple Cloning Site), zwiększenia liczby kopii plazmidów w komórce, udoskonalenia metody selekcji klonów zawierających zrekombinowany DNA oraz skonstruowania wektorów wielofunkcyjnych, służących do szczegółowej analizy genów [4].
Przykładami tak ulepszonych plazmidów są plazmidy z serii pUC, które posiadają 40% wspólnego DNA z plazmidem pBR322. Są to niewielkie plazmidy o wielkości 2686 pz, niosące gen oporności na ampicylinę oraz N-końcowy fragment genu β-galaktozydazy (lacZ).Plazmidy pUC występują w większej liczbie kopii na komórkę (do 500 kopii) w porównaniu z plazmidem pBR322. Ponadto zawierają one polilinker, w którym znajdują się sekwencje rozpoznawane przez wiele enzymów restrykcyjnych. Ich zaletą jest również prostszy sposób selekcji komórek zawierających zrekombinowane DNA. Wizualna identyfikacja zrekombinowanych klonów jest możliwa po włączeniu do wektora genu kodującego enzym, który rozkłada barwny substrat. Miejsce klonowania obcego DNA znajduje się w obrębie tego genu. Kolonie komórek zawierających plazmid pUC z dodatkowo wstawionym DNA będą miały inny kolor, od tych które zawierają sam, niezmieniony plazmid pUC (selekcja na biało-niebieskie kolonie) [4].
Obecnie wektory klonujące są często tworzone przez różne firmy komercyjne. Wektory te są zaprojektowane w taki sposób aby ułatwić i przyspieszyć pracę w laboratorium. Przykład mogą stanowić wektory pDrive, pGEM T i pGEM T easy oraz wektory z topoizomerazą skonstruowane w celu szybkiego klonowania produktów reakcji PCR. Kolejnym przykładem mogą być wektory zwane BAC (bacterial artificial chromosomes) czyli sztuczne chromosomy bakteryjne. Wektory BAC skonstruowane są na bazie wektora plazmidowego F powszechnie występującego u Escherichiacoli. Ich podstawowymi elementami funkcjonalnymi są elementy kontroli oraz regulacji replikacji i segregacji pochodzące z episomu F E. coli. Główną zaletą wektorów BAC jest możliwość klonowania na nich dużych fragmentów obcego DNA (do 300 kpz). Znakomicie nadają się one do tworzenia bibliotek genomowych, pozwalają na zawarcie całego genomu danego organizmu w niewielkiej liczbie klonów [4].
Sklonowane fragmenty DNA mogą być wykorzystywane do różnych celów, takich jak izolacja genów, analiza ich organizacji i ekspresji oraz odczytanie sekwencji nukleotydowej. Możliwość wyizolowania i sklonowania wybranego fragmentu DNA umożliwiła szukanie mutacji i polimorfizmów związanych z daną chorobą, identyfikowanie ekspresji genów w wybranych tkankach oraz warunków ekspresji genów. Wektory bakteryjne znalazły szerokie zastosowanie w biologii molekularnej i komórkowej, biochemii oraz medycynie genetycznej. Cały czas prowadzone są badania nad skonstruowaniem bardziej wyspecjalizowanych wektorów klonujących, zdolnych do przenoszenia coraz większych fragmentów DNA [4].
Zastosowanie wektorów bakteryjnych do przenoszenia genów pomiędzy organizmami
Kolejnym zastosowaniem wektorów bakteryjnych jest wykorzystanie ich do przenoszenia genów pomiędzy różnymi organizmami. Wektory umożliwiające przenoszenie DNA między różnymi gatunkami nazywane są wektorami wahadłowymi lub bifunkcjonalnymi. Wektory tego typu są zdolne do replikacji w różnych organizmach prokariotycznych lub zarówno w prokariotycznych jak i eukariotycznych komórkach gospodarzy, np. w komórkach E.coli i Streptomyces spp. oraz E.coli i komórkach ssaków. Typowy wektor wahadłowy do klonowania w komórkach eukariotycznych skonstruowany jest z części prokariotycznej i eukariotycznej (Rys.2). Część prokariotyczna wektora zawiera sekwencję orii marker selekcyjny, a eukariotyczna sekwencję ori rozpoznawaną przez polimerazę DNA gospodarza eukariotycznego, marker selekcyjny oraz sekwencje umożliwiające ekspresję genu. Obecność markerów selekcyjnych zarówno w części prokariotycznej jak i eukariotycznej umożliwia selekcję w obu gospodarzach. Eukariotyczny kompleks ekspresyjny składa się z promotora, miejsca do klonowania (sekwencji „polilinkera”) rozpoznawanego przez wiele enzymów restrykcyjnych, sekwencji intronowej umożliwiającej prawidłowe dojrzewanie klonowanego DNA eukariotycznego i terminatora transkrypcji. Za promotorem może się również znajdować włączona sekwencja ułatwiająca sekrecję syntetyzowanego białka [2].
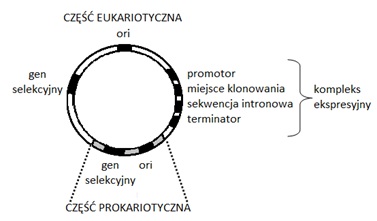
Rys.2. Schemat wektora wahadłowego stosowanego do klonowania fragmentów eukariotycznego DNA.
Wektory wahadłowe umożliwiają wprowadzenie fragmentów DNA do genetycznie odległych organizmów, gdzie ich ekspresja, modyfikacja, replikacja, degradacja itp. mogą być przedmiotem szczegółowych badań. Wektory bakteryjne na przykład w postaci plazmidu mogą być nośnikami fragmentu DNA, który ma zostać umieszczony w komórce eukariotycznej. Istnieje wówczas konieczność użycia kolejnego wektora, który dostarczy plazmid do komórki. W tym celu stosowane są zazwyczaj komórki bakteryjne takie jak Escherichia coli lub Listeria monocytogenes z wklonowanymi genami pochodzącymi od bakterii z rodzaju Yersinia lub Listeria. Takie systemy pozwalają na dostarczenie do komórek eukariotycznych DNA lub białka, które mogą indukować komórkową odpowiedź immunologiczną organizmu (szczepionki nowej generacji). Przykład może stanowić wykorzystanie atenuownego szczepu bakterii L. monocytogenes w celu dostarczenia przez wektor bakteryjny genu kodującego antygen do cytozolu makrofagów. Po wniknięciu do cytozolu makrofagów komórki bakteryjne są lizowane, co umożliwia uwolnienie plazmidów wektorów ekspresyjnych, które znajdowały się w cytoplazmie komórek L. monocytogenes. Plazmidy te są zdolne do ekspresji w jądrze makrofagów, ponieważ zawierają eukariotyczne promotory. W ten sposób można uzyskać efektywną ekspresję wklonowanych genów reporterowych oraz prezentację antygenu [4].
Zastosowanie wektorów bakteryjnych do produkcji białek
Wektory bakteryjne mogą być także stosowane do produkcji białek oraz ich oczyszczania. Oprócz właściwego wektora do produkcji określonego białka niezbędne są także gen bądź fragment genu, kodujący oczyszczane białko oraz odpowiedni gospodarz. Gospodarz powinien być dobrany w stosunku do genu danego białka. Istotne jest aby nie występowały znaczące różnice w częstotliwości występowania poszczególnych kodonów gospodarza w stosunku do genu białka, mRNA powinno być stabilne, a jego translacja przebiegać efektywnie. Ponadto gospodarz musi umożliwić poprawne przeprowadzanie procesów takich jak modyfikacje posttranslacyjne białek, fałdowanie białek oraz sekrecję białek do podłoża. Natomiast powstające w dużych ilościach białko nie powinno być toksyczne dla gospodarza [4].Bakteryjne systemy ekspresyjne najczęściej wykorzystują pałeczki Escherichia coli. Jest to organizm modelowy stosowany w badaniach genetycznych ze względu na swoje cechy. Genom oraz warunki hodowli E.coli zostały bardzo dobrze poznane. Wiąże się to z szeroką dostępnością zarówno różnych szczepów, jak i wektorów, które mogą być wykorzystywane do badań. Inną zaletą E. coli jest stosunkowo niski koszt produkcji, ponieważ jest ona zdolna do szybkiego wzrostu na tanich substratach. Pomimo licznych zalet E.coli posiada także pewne wady. Niepatogenne szczepy tej bakterii nie posiadają efektywnych mechanizmów sekrecji białek do podłoża. Ponadto w ich komórkach nie ma możliwości uzyskania niektórych typów cząsteczek, np. peptydów błonowych. Dużym problemem, zwłaszcza w przypadku białek terapeutycznych, jest również obecność lipopolisacharydu wchodzącego w skład ściany komórkowej E. coli. Podczas izolacji może się on przedostawać do produkowanego białka i wykazywać właściwości pirogenne. W przypadku, kiedy nie możemy jako gospodarza użyć szczepu E. coli alternatywę mogą stanowić bakterie z rodzaju Bacillus, Streptomyces czy Lactococcuslactis. Czasami także zdarza się, że niezbędne jest zastosowanie gospodarzy innych niż bakteryjne. Jest to związane z tym, że żadne organizmy prokariotyczne nie są zdolne do wycinania niekodujących sekwencji DNA oraz przeprowadzania modyfikacji posttranslacyjnych. W związku z tym białka eukariotyczne wytwarzane w komórkach bakteryjnych mogą być niestabilne lub nieaktywne biologicznie. Istotna jest również wielkość transgenu. Białka o masie cząsteczkowej powyżej 30 kDa mogą ulegać nieprawidłowemu fałdowaniu w komórkach bakteryjnych. W niektórych przypadkach produkty wprowadzonych genów są uznawane za obce i niszczone [5].
Aby ekspresja zrekombinowanych genów była możliwa, niezbędne jest zastosowanie wektorów ekspresyjnych (Rys.3). Nośniki te, oprócz elementów charakterystycznych dla wektora klonującego, zawierają również silny promotor, który umożliwia produkcję dużej ilości białka w komórce biorcy. Sekwencja promotorowa inicjacji transkrypcji znajduje się powyżej miejsca wklonowania fragmentu DNA.Za miejscem inicjacji transkrypcji umieszczone jest miejsce wiązania rybosomu (sekwencja Shine-Dalgarno). Wydajność wiązania rybosomu z tą sekwencją wpływa na poziom syntezy białka. Poniżej sekwencji Shine-Dalgarno znajduje się miejsce insercji klonowanego DNA. Na początku fragmentu obcego DNA znajduje się kodon AUG inicjujący translację, a na końcu kodon stop, który kończy syntezę polipeptydu. Terminator transkrypcji może być umieszczony poniżej klonowanego DNA (co zapobiega transkrypcji przez miejsce inicjacji replikacji zwiększając stabilność plazmidu) oraz powyżej (w celu zmniejszenia ekspresji podstawowej). Oprócz tych sekwencji wektory ekspresyjne posiadają również miejsce inicjacji replikacji oraz marker selekcyjny. Najczęściej w wektorach ekspresyjnych stosowane są jako markery selekcyjne geny warunkujące oporność na antybiotyki [5].
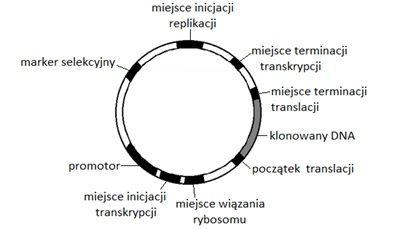
Rys.3. Schemat wektora ekspresyjnego.
Przykładem wektora ekspresyjnego stosowanego do produkcji białek może być plazmid pUB110, który zawiera geny oporności na dwa antybiotyki: bleomycynę i kanamycnę. Wektor pUB oraz jego pochodne zostały wyizolowane ze szczepu Staphylococcus aureus. Wykazano, że jest on zdolny do autonomicznej replikacji w komórkach Bacillus subtilis. Wektor pUB110 charakteryzuje się dużą liczbą kopii (około 50 na komórkę) oraz stosunkowo wysoką stabilnością u B. subtilis. Istnieje wiele miejsc restrykcyjnych dla tego plazmidu. Wektor pUB110 daje się łatwo transformować do komórek gospodarza i pozwala na efektywną selekcję zrekombinowanych komórek. Ze względu na możliwość wykorzystywania wektorów tego rodzaju przy pracy z B. subtilis mogą być one również stosowane do analizy procesu sporulacji, kiełkowania przetrwalników i transformacji. Istnieje także możliwość zastosowania wektorów pUB110 w celu porównania systemu ekspresji genów z B. subtilis w stosunku do E. coli. Ponadto komórki B. subtilis nie posiadają zewnętrznej błony, co może znacznie ułatwić sekrecję i oczyszczanie produkowanego białka [4].
Innym przykładem wektorów ekspresyjnych są wektory typu pET – pochodne plazmidu pBR322. Istnieje wiele wektorów serii pET, które mogą różnić się między sobą poszczególnymi elementami funkcjonalnymi w zależności od celu wykorzystania. Zwykle jednak wyróżnia się dwie grupy wektorów pET pełniących funkcje wektorów transkrypcyjnych lub translacyjnych. Wektory transkrypcyjne umożliwiają ekspresję docelowego RNA, ale nie zawierają sygnałów translacyjnych. Wektory tego typu są stosowane, wówczas gdy konieczne jest uzyskanie białek kodowanych przez geny, które posiadają własne sygnały translacyjne. Natomiast wektory translacyjne zawierają sygnały inicjacji translacji. Wektory typu pET są wykorzystywane do klonowania i nadprodukcji białek w komórkach E. coli [4].
Wektory ekspresyjne mogą być wykorzystywane do produkcji białek w celach poznawczych takich jak analizy strukturalne i funkcjonalne, lub aplikacyjnych jak profilaktyka i terapia chorób organicznych i zakaźnych. Umożliwiają one produkcję białek, które w organizmach żywych występują w niewielkich ilościach. Zastosowanie białek rekombinowanych w lecznictwie i farmaceutyce doprowadziło do znacznego postępu w zwalczaniu wielu chorób orazzwiększenia wydajności produkcji leków i ich dostępności. Ponadto eliminuje problem niezgodności i ogranicza zagrożenie związane z przenoszeniem czynników chorobotwórczych [4].
Pierwszym białkiem z organizmu ssaków stworzonym przy użyciu technik rekombinacji DNA była ludzka insulina. Insulina jest bardzo ważnym lekiem ratującym życie milionom chorych na cukrzycę na całym świecie. Preparat ludzkiej insuliny można otrzymać poprzez oddzielne wklonowanie do plazmidu pBR322 fragmentów DNA kodujących łańcuch A i B insuliny i umieszczenie w fuzji z genem β-galaktozydazy. Metoda ta pozwala na uzyskanie dowolnych ilości oczyszczonej insuliny ludzkiej bez udziału komórek beta wysp trzustki. Dzięki temu trzustka zwierzęca straciła znaczenie jako surowiec do produkcji insuliny. Zastosowanie insuliny ludzkiej w leczeniu cukrzycy ma znaczną przewagę nad stosowaniem insuliny zwierzęcej. Insulina zwierzęca może powodować u chorych produkcję przeciwciał oraz stan zapalny. Natomiast insulina ludzka stworzona przy użyciu technik rekombinacji DNA jest podobna do tej, która jest produkowana w organizmie człowieka. Jest więc dużo lepiej tolerowana przez pacjentów. Pierwszym preparatem zawierającym ludzką insulinę był lek lispro, który został wprowadzony na rynek w 1996 roku [4].
Wektory bakteryjne są także stosowane do produkcji szczepionek nowej generacji. Obecnie nadal większość szczepionek stanowią szczepionki tradycyjne, skonstruowane w oparciu o atenuowane lub zabite mikroorganizmy albo oczyszczone toksyny bakteryjne. Konstruowane są one poprzez kilkukrotne pasażowanie patogenu bądź przez poddawanie go mutagenezie chemicznej lub fizycznej. Mutacje powstające w genomie w ten sposób są przypadkowe przez co istnieje ryzyko rewersji szczepu do pełnej zjadliwości. Zastosowanie technik rekombinacji DNA pozwala na wprowadzanie ściśle określonych mutacji, co zmniejsza szansę rewersji szczepu do typu wirulentnego. Szczepionki nowej generacji zapewniają wyższą efektywność oraz bezpieczeństwo dla pacjenta. Innymi zaletami szczepionek tego rodzaju są zwiększona immunogenność, brak konieczności stosowania adiuwantów, łatwość podawania i przechowywania, możliwość immunizacji wieloma antygenami równocześnie oraz możliwość indukcji konkretnego typu odpowiedzi [4].
Szczepionki wektorowe wykorzystują żywe niepatogenne bakterie, do których genomu wprowadzono geny kodujące antygen chorobotwórczego drobnoustroju. W celu umieszczenia heterologicznych genów w komórkach nośnika można zastosować plazmidy, które po dostarczeniu do komórki docelowej będą występowały w cytoplazmie w różnej ilości kopii. Zaletą takiego podejścia jest możliwość sterowania ilością produktu obcego genu. Wadą natomiast to, że plazmidy w warunkach in vivo bez presji selekcyjnej nie są stabilnie utrzymywane. Oprócz wektora bakteryjnego w postaci plazmidu niezbędny jest jeszcze jeden wektor, pozwalający na dostarczenie heterologicznego antygenu do komórek eukariotycznych. Wektorem tym jest najczęściej zrekombinowany szczep bakteryjny, którego biologia jest dostatecznie dobrze poznana. Pozwala on na dostarczenie plazmidu do cytoplazmy komórki docelowej. Najczęściej stosowanymi szczepami nośnikowymi są bakterie należące do rodzajów Vibrio, Shigella, Listeria oraz gatunków Mycobacterium bovis i Salmonella enterica [4].
Autor: Katarzyna Czuba
Literatura:
1. Węgleński P. Genetyka molekularna. Wyd. Naukowe PWN. Warszawa, 2007.
2. Kur J. Podstawy inżynierii genetycznej. Wyd. Politechniki Gdańskiej. Gdańsk, 1994.
3. http://www.biol.uw.edu.pl/zbm/pliki/Skrypt_BM_wir.pdf
4. Staworzyńska M. J., Stachowiak R., Bielecki J. Zastosowanie wektorów bakteryjnych w biologii molekularnej i w medycynie. Post. Mikrobiol. 2011, 50, 1, 3-16.
5. Staroń A., Grabowska A., Jagusztyn-Krynicka E. K. Nadprodukcja i oczyszczanie rekombinowanych, heterologicznych białek w komórkach Escherichia coli. Post. Mikrobiol. 2008, 47, 2, 83-95.









Recenzje