- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Wybrane metody oznaczania bilirubiny w surowicy krwi cz.I
Bilirubina jest produktem degradacji części porfirynowej hemu,który uwalniany jest z hemoglobiny w śledzionie, wątrobie lub szpiku kostnym. Część białkowa hemu (globina) degradowana jest do pojedynczych aminokwasów. W wyniku tej reakcji atom żelaza z porfiryny zostaje włączony do ogólnej puli żelaza organizmu, zaś hem ulega przekształceniu w biliwerdynę (linearna cząsteczka), która następnie redukowana jest do bilirubiny [4].
Bilirubina jest pomarańczowo-żółtym barwnikiem będącym ubocznym produktem normalnego rozpadu krwinek czerwonych w organizmie. Bilirubina przechodzi przez wątrobę i wydalana jest z organizmu głównie z kałem i w małej ilości w moczu. W wątrobie bilirubina łączy się z pewnymi cukrami tworząc rozpuszczalną w wodzie formę zwaną bilirubiną związaną. Związana bilirubina przechodzi z wątroby do okrężnicy gdzie przekształcana jest z powrotem w formę niezwiązaną, która to następnie wydalana jest z organizmu.
W większości laboratoriów stężenie bilirubiny oznaczane jest za pomocą tzw. testu bezpośredniego. W wyniku odjęcia wartości bilirubiny bezpośredniej od bilirubiny całkowitej otrzymuje się wartość bilirubiny wolnej (zwanej pośrednią)[3].
Zdjęcie: wzór bilirubiny, http://www.daviddarling.info/encyclopedia/B/bilirubin.html
Bilirubina pośrednia (tj. bilirubina niesprzężona) jest produktem katabolizmu hemu. Związek ten powstaje głównie z rozpadu krążących erytrocytów. Bilirubina pośrednia jest lipofilna i nie rozpuszcza się w wodzie. Krążąc we krwi wiąże się z albuminami i w postaci związanej jest ona dalej transportowana. W przypadku wysokich stężeń bilirubiny, kwasicy, niedotlenienia, hipoglikemii, hipotermii bądź obecności niektórych związków chemicznych (np. penicylin) zdolność wiążąca albumin ulega zmniejszeniu, co prowadzi do wzrostu procentowego udziału bilirubiny krążącej we krwi, niezwiązanej z białkami (frakcja ta wykazuje właściwości neurotoksyczne dla organizmu).
Do przekształcenia bilirubiny niesprzężonej (pośredniej) w bilirubinę sprzężoną (bezpośrednią) dochodzi w komórkach wątrobowych pod wpływem związku znanego jako urydylo-difosfo-glukuronylotransferazy (UDPG-T). Bilirubina sprzężona jest związkiem rozpuszczalnym w wodzie, który z żółcią wydalany jest do przewodu pokarmowego, a następnie przy udziale enzymów wytwarzanych przez endogenną florę bakteryjną przekształcana jest do urobilinogenu i sterkobiliny [2]. Obecna w błonie śluzowej jelita β-glukuronidaza ma zdolność hydrolizowania bilirubiny sprzężonej do niesprzężonej, która następnie może ulec reabsorbcji do krwi i ponownej koniugacji w wątrobie (tzw. krążenie jelitowo–wątrobowe bilirubiny) [2].
Neurotoksyczne działanie bilirubiny
Po przekroczeniu wartości krytycznych bilirubina pośrednia (tj. forma niezwiązana z białkami osocza) może przenikać przez barierę krew–mózg w wyniku czego dochodzi do uszkadzania komórek nerwowych. Z kolei, bilirubina związana z albuminami może przekraczać barierę krew-mózg jedynie w przypadku, gdy dojdzie do jej uszkodzenia. Nie do końca jest znany związek pomiędzy uszkodzeniem ośrodkowego układu nerwowego (OUN) a czasem trwania i poziomem hiperbilirubinemii. Jednakże uważa się, że stężenie bilirubiny niezwiązanej z albuminami ma dużo większy wpływ na ryzyko powstania encefalopatii bilirubinowej niż stężenie bilirubiny całkowitej [2].
Zaburzenia neurologiczne powstające wskutek toksycznego działania bilirubiny zazwyczaj charakteryzują się zróżnicowanym nasileniem. Mogą one przybierać formę od łagodnej do przejściowej encefalopatii, a nawet do trwałego uszkodzenia jąder podkorowych mózgu. Wśród objawów uszkodzenia neuronów u noworodków w wyniku hiperbilirubinemii najczęściej wymienia się objawy niespecyficzne (niechęć do ssania, apatia, spadek napięcia mięśniowego), które stopniowo przechodzą w bardziej zaawansowaną formę (m.in. wzrost napięcia mięśni prostownika, hipertermia, zaburzenia wzroku i słuchu). U dzieci, które przeżyją dochodzi do trwałego uszkodzenia układu nerwowego [2].
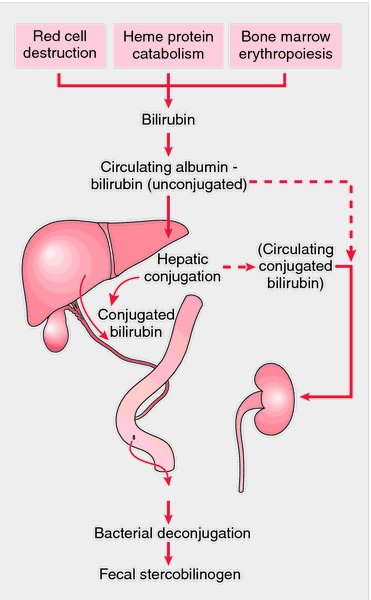
Zdjęcie: metabolizm bilirubiny, http://medical-dictionary.thefreedictionary.com/bilirubin
Oznaczanie bilirubiny w surowicy metodą Jendrasika (wg Kokot F., 1969) [9].
Bilirubina zawarta w surowicy krwi w obecności kofeiny i pod działaniem diazowanego kwasu sulfanilowego ulega reakcji azowania, która przebiega w odpowiednim pH. W wyniku tej reakcji powstaje związek o różowym zabarwieniu, którym jest azobilirubina. W przypadku braku kofeiny w reakcji, z odczynnikiem diazowym reaguje jedynie bezpośrednia forma bilirubiny. W wyniku odjęcia wartości stężenia bilirubiny bezpośredniej od bilirubiny całkowitej (czyli tej oznaczonej w obecności kofeiny) można oznaczyć stężenie tzw. bilirubiny pośredniej.
Przygotowanie odczynnika diazowego:
Roztwór A: rozpuścić 5 g kwasu sulfanilowego w ok. 950 ml wody, dodać 15 ml stężonego roztworu HCl, po czym uzupełnić wodą do objętości 1000 ml (roztwór trwały).
Roztwór B: 0,5% roztwór NaNO2 (roztwór nietrwały).
Bezpośrednio przed użyciem odczynnika zmieszać 10 ml roztworu A i 0,25 ml roztworu B.
Odczynnik kofeinowy: 20 g kofeiny, 30 g benzoesanu sodu i 50 g CH3COONa należy rozpuścić w wodzie (ogrzewając roztwór), a następnie całość uzupełnić do objętości równej 400 ml za pomocą wodą.
Etanolowy roztwór wodorowęglanu: 0,6 g NaHCO3 i 3 g NaCl rozpuścić w 1000 ml 70% roztworu etanolu.
Wykonanie oznaczenia:
W przypadku wykonywania oznaczenia na surowicy żółtaczkowej (kolor bursztynowy) próbkę przed oznaczeniem należy kilkakrotnie rozcieńczyć 0,9% roztworem NaCl. Rozcieńczenie następnie uwzględnia się w obliczeniu stężenia bilirubiny.
Do przygotowanych 4 probówek odmierzyć ilości roztworów (ml) wg podanej tabeli:

Po 5-minutowej inkubacji próbek należy odczytać wartość absorbancji przy długości fali równej λ=540 nm wobec próbki kontrolnej (woda).
Wartość Aabsorbancji dla bilirubiny całkowitej = A (absorbancja probówki nr 1) – A (absorbancja probówki nr 3)
Wartość A dla bilirubiny bezpośredniej = A (probówki nr 2) – A (probówki nr 3)
Przygotowanie roztworu wzorcowego:
1 ml roztworu wzorcowego odparować do sucha w łaźni o temperaturze 70°C. Otrzymaną suchą pozostałość rozpuścić w 1 ml etanolowego roztworu wodorowęglanu (tj.: 0,6 g NaHCO3 i 3 g NaCl rozpuścić w 1000 ml 70% roztworu etanolu). Do roztworu dodać bezpośrednio odczynnik kofeinowy oraz diazowy (bez uprzedniego odparowywania w łaźni). Następnie odczytać wartość absorbancji (wobec wody).
Obliczenia: mg/100 ml = (Apb / Aw) ∙ 2
Gdzie:
Apb– wartość absorbancji bilirubiny pośredniej otrzymanej przez odjęcie stężenia bilirubiny bezpośredniej od bilirubiny całkowitej
Aw- wartość absorbancji wzorca [1], [9].
Prawidłowe poziomy bilirubiny – diagnostyka żółtaczki
Zwiększenie stężenia bilirubiny we krwi powyżej 17 umol/1 (1 mg/dl) oznacza hiperbilirubinemię. Hiperbilirubinemia może być wynikiem wytwarzania większej ilości bilirubiny niż wydala zdrowa wątroba lub też skutkiem niewydolności uszkodzonej wątroby do wydalania bilirubiny powstającej w ilościach prawidłowych. Wśród przyczyn powstania hiperbilirubinemii wymienia się również uszkodzenia wątroby czy zaczopowanie przewodów żółciowych wątroby, co uniemożliwia wydalanie żółci. Zatrzymana bilirubina gromadzi się we krwi, a po przekroczeniu pewnego stężenia dyfunduje do tkanek, czego wynikiem jest ich zażółcenie- znane jako żółtaczka [5].
Ilościowy pomiar zawartości bilirubiny w surowicy – test Ehrlicha
Oznaczanie stężenia bilirubiny jest nieodzownym elementem w badaniach klinicznych żółtaczek. Jako pierwszy metodę ilościowego pomiaru zawartości bilirubiny w surowicy wprowadził Van den Bergh. W oznaczeniu wykorzystano test Ehrlicha na bilirubinę w moczu.
Test Ehrlicha polega na reakcji diazowanego kwasu sulfanilowego (tzw. odczynnik diazowy Ehrlicha) i bilirubiny, w wyniku czego dochodzi do utworzenia czerwono-purpurowego związku azowego. W oryginalnej metodzie Ehrlicha do rozpuszczenia bilirubiny i odczynnika diazowego wykorzystywano metanol, jednakże przypadkowe pominięcie przez Van den Bergha metanolu podczas oznaczania barwników żółciowych w żółci doprowadziło do wykrycia, że reakcja barwna zachodzi „bezpośrednio". Stąd też bilirubina, która reaguje w nieobecności metanolu określona jest bilirubiną bezpośrednią. Doświadczalnie stwierdzono, że identyczna reakcja zachodzi również w surowicy chorych z żółtaczką mechaniczną. Stosowanie dodatku metanol w tej metodzie było nadal konieczne w przypadku oznaczania bilirubiny w surowicy prawidłowej i bilirubiny występującej w zwiększonej ilości w surowicy u chorych z żółtaczką hemolityczną, u których to nie stwierdzono niedrożności przewodów żółciowych. Bilirubina, która może być oznaczona jedynie po dodaniu do próbki metanolu, określana jest bilirubiną pośrednią [5].
Prawidłowy poziom bilirubiny całkowitej w surowicy krwi człowieka waha się w zakresie od 0,3 do 1,0 mg/dl lub od 5,1 do 17,0 µmol/l. Przekroczenie stężenia 2 -2,5 mg/100 ml krwi powoduje, że bilirubina dyfunduje do tkanek, czego wynikiem jest rozwój żółtaczki. Wzrost stężenia bilirubiny w osoczu określany jest mianem hiperbilirubinemii, która może być spowodowana zwiększonym wytwarzaniem bilirubiny w wyniku:
- żółtaczki mechanicznej (brak nieprawidłowości w pracy wątroby, brak zaburzeń związanych z rozpadem czerwonych krwinek, ten rodzaj żółtaczki rozwija się w wyniku np. zwężenia lub zamknięcia dróg żółciowych od wewnątrz, w wyniku czego żółć nie może prawidłowo spływać do dwunastnicy),
- zespołu Dubina-Jansona (zaburzony transport sprzężonej bilirubiny do kanalików żółciowych),
- schorzenia dróg żółciowych lub pęcherzyka żółciowego,
- niezdolnością wydzielania bilirubiny powstającej w prawidłowych ilościach przez uszkodzoną wątrobę [4], [6].
Oznaczanie bilirubiny całkowitej i bezpośredniej (z wykorzystaniem gotowego zestawu odczynników do pomiaru stężenia bilirubiny, BioSystems S.A., procedura ze strony: http://chemklin.sum.edu.pl/uploaded/BILIRUBINA.pdf)
Zasada metody: w wyniku reakcji z dwuazowym kwasem sulfanilowym bilirubina bezpośrednia w próbce badanej tworzy barwny kompleks, który może być zmierzony spektrofotometrycznie. Bilirubina bezpośrednia i pośrednia w obecności cetrymidu tworzą związek dwuazowy [7].
Odczynniki zestawu:
- standard bilirubiny: rozpuścić w 5 ml wody destylowanej. Standard jest stabilny przez 4 godziny w temp. 15-30°C lub 2 miesiące w temp. -18°C,
- odczynnik AT (bilirubina całkowita): kwas sulfanilowy 29 mmol/L, kwas chlorowodorowy 0,2 mol/L, cetrimid 50 mmol/L,
- odczynnik BT (bilirubina całkowita): azotyn sodowy 11,6 mmol/L,
- odczynnik AD (bilirubina bezpośrednia): kwas sulfanilowy 35 mmol/L, kwas chlorowodorowy 0,24 mol/L,
- odczynnik BD (bilirubina bezpośrednia: azotyn sodowy 3,5 mmol/L,
- odczynnik roboczy (dla określenia bilirubiny całkowitej): zawartość fiolki odczynnika BT należy przenieść do butelki odczynnika AT, lekko wstrząsnąć,
- odczynnik roboczy (dla określenia bilirubiny bezpośredniej): zawartość fiolki odczynnika BD przenieść do butelki odczynnika AD (lekko wstrząsnąć),
- materiał do badań: surowica pobrana zgodnie ze standardowymi procedurami (bilirubina w surowicy stabilna jest przez 2 dni w temp. 2-8°C jeżeli chroniona jest przez dostępem światła [7].
Wykonanie oznaczenia bilirubiny całkowitej:
1) Do oznaczonych probówek odpipetować odpowiednie ilości odczynników (wg poniższej tabeli):

Zdjęcie: http://chemklin.sum.edu.pl/uploaded/BILIRUBINA.pdf
1) Zawartość probówek dokładnie wymieszać i pozostawić na 2-minutową inkubację w temperaturze pokojowej
2) Zmierzyć wartości absorbancji (A)prób ślepych surowicy przy długości fali równej λ=540 nm względem wody destylowanej
3) Zmierzyć absorbancję prób badanych i standardu przy λ=540 nm wobec próby ślepej odczynnikowej [7].
Wykonanie oznaczenia bilirubiny bezpośredniej:
1) Do oznaczonych próbek odpipetować odczynniki wg kolejności podanej w tabeli:

Zdjęcie: http://chemklin.sum.edu.pl/uploaded/BILIRUBINA.pdf
1) Zawartość probówek wymieszać, po czym zostawić je na dokładnie 5 minut w temperaturze 37°C
2) Odczytać absorbancję (A) prób ślepych surowicy przy λ= 540 nm wobec wody destylowanej
3) Następnie zmierzyć absorbancję (A) prób badanych przy λ=540 nm wobec próby ślepej odczynnikowej [7].
Na podstawie uzyskanych wyników absorbancji należy obliczyć stężenie bilirubiny w próbce wg wzoru:
A próby - A próby ślepej / A standardu x C standardu = C próby
Uwagi:
W obliczeniach bilirubiny bezpośredniej należy wykorzystać wartość absorbancji uzyskanej dla standardu w procedurze oznaczania bilirubiny całkowitej.
Stężenie wagowe (mg/dl) x 17,1 = stężenie molowe (µmol/L) [7].
Wartości referencyjne dla dorosłych: bilirubina całkowita powinna mieścić się w granicach do 1,0 mg/dl = 17 µmol/l, zaś bilirubina bezpośrednia w granicach do 0,2 mg/dl = 3,4 µmol/l [7].
Pomiary fotometryczne bilirubiny
Obecne technologie pozwalają na określanie wartość bilirubiny przy użyciu kilku metod, zarówno inwazyjnych jak i i nieinwazyjnych. Metody inwazyjne opierają się na pomiarze stężenia bilirubiny np. w krwi żylnej, płynie owodniowym czy płynie mózgowo-rdzeniowym [8].
Bezpośrednie pomiary fotometryczne bilirubiny oparte są na pomiarze jej stężenia w rozpuszczonej surowicy przy długości fali równej λ=455 nm (tj. maksymalna absorpcja bilirubiny). Pomiar bezpośredni może być wykonywany u noworodków, ponieważ w przypadku dzieci i dorosłych surowica może zawierać wiele dodatkowych pigmentów o podobnych kolorach i reakcjach jak bilirubina, co znacznie utrudnia pomiar. Ponadto pomiar bezpośredni może być zakłócony przez opalescencję, która wynika z rozcieńczenia surowicy lub obecności oksyhemoglobiny w surowicy noworodków. Zakłócenia te mogą być stłumione przez wykonanie odpowiedniej korekty w trakcie oznaczania stężenia polegającej na pomiarach przy dwóch długościach fali tj. 455 nm i 575 nm [8].
Spektrofotometryczną metodę oznaczania zawartości bilirubiny w pełnej krwi opracowano pod koniec 1990r. Wykorzystywane w tym celu analizatory wyposażone są w CO-oksymetr, który umożliwia określenie stężenia bilirubiny i różnych form hemoglobiny (całkowitą hemoglobinę, oksyhemoglobinę, methemoglobinę). Pomimo różnicy w spektrach absorpcji dla bilirubiny i hemoglobiny, duża różnica w stężeniach obu parametrów wymaga skomplikowanego procesu pomiarowego. Analizator musi być w stanie ilościowo określić poszczególne postacie bilirubiny, które różnią się między sobą zakresami maksimum absorpcji:
- 459 nm – niezwiązana bilirubina
- 422 nm – bilirubina związana
- 433 nm – delta-bilirubina (frakcja bilirubiny sprzężonej, związanej kowalencyjnie z albuminami- nie występuje u osób zdrowych)[8].
Na rynku dostępne jest bardzo nowoczesne urządzenie wykorzystywane do pomiaru przewidywanych wartości bilirubiny w mg/dl lub µmol/l, znane jako „Bilirubinometr BiliChek”. Analizator stężenia bilirubiny BiliChek jest nieinwazyjnym przezskórnym bilirubinometrem, którego wyniki stanowią wskaźnik predyktywny poziomu bilirubiny w surowicy u noworodków przed fototerapią, w jej trakcie i po zakończeniu. Badania przeprowadzone na bilirubinometrze potwierdziły, że wyniki otrzymywane z jego zastosowaniem odpowiadają danym uzyskiwanym za pomocą wysokiej klasy analizatorów krwi (opartych na technologii HPLC), których dokładność kształtuje się na poziomie +/- 1,5 mg/dl.
Bilirubinometr dokonuje pomiaru w zakresie długości fali od 380 do 760 nm, wykorzystując więcej niż 100 punktów odczytu. Ponadto w trakcie pomiaru dokonywana jest korekta wyników zmienionych przez czynniki zakłócające takie jak: hemoglobina, melanina czy grubość skóry [8].
Bilirubinometr BiliChek zyskał akceptację w zastosowaniach medycznych w wielu badaniach klinicznych, co potwierdza jego przydatność w ocenie poziomów ryzyka hiperbilirubinemii u noworodków. Zalecany jest do stosowania przez cały czas prowadzenia fototerapii u noworodków (od 27. do 42. tygodnia wieku ciążowego i do 20. dnia okresu poporodowego) [10].
Przygotowanie próbek krwi do pomiaru stężenia bilirubiny
Pobieranie krwi do badania nie wymaga żadnych specjalnych procedur. Największy wpływ na wyniki ma niewłaściwe przechowywanie próbek, co często jest przyczyną błędów. Zazwyczaj złe przechowywanie objawia się niższymi wynikami. Bilirubina jest bardzo wrażliwa na światło, tak więc badane osocze krwi lub surowica nie mogą być narażone na bezpośrednie działanie światła. Ponadto rozkład próbek przyśpieszany jest przez podwyższoną temperaturę, dlatego też pobrane próbki należy od razu poddawać oznaczeniu lub przechowywać je w chłodnym i ciemnym miejscu nie dłużej niż 12 godzin [8].
Autor: Lidia Koperwas
Literatura:
[1]. Kokot F., 1969. Metody badań laboratoryjnych stosowanych w klinice.PZWL, Warszawa, 300-301.
[2]. Wasiluk A., Polewko A., Ozimirski A., 2012. Współczesna diagnostyka i leczenie żółtaczek u noworodków i niemowląt. Praca poglądowa. Diagnostyka laboratoryjna, Journal of Laboratory Diagnostics 2012, Volume 48, Number 4, 405-411. http://www.diagnostykalaboratoryjna.eu/journal/DL_4_2012._str_405-411.pdf
[3]. http://www.mayoclinic.org/tests-procedures/bilirubin/basics/definition/prc-20019986
[4]. http://www.pchba.amu.edu.pl/cw%20CBA/cw4.pdf
[5]. Murray R.K., Granner D.K., Mayes P.A., Rodwell V.W.,1995. BIOCHEMIA HARPERA, Wydanie III, Redaktor naukowy tłumaczenia Franciszek Kokot. Wydawnictwo Lekarskie PZWL, s.411-413.
[6]. http://zdrowie.gazeta.pl/Zdrowie/1,105912,13834460,Zespol_Dubina_Johnsona.html
[7]. BioSystems S.A., Costa Brava, Spain. http://chemklin.sum.edu.pl/uploaded/BILIRUBINA.pdf
[8]. Penhaker M., Kasik V., Hrvolova B.,2013. Advanced Bilirubin Measurement by a Photometric Method. ELEKTRONIKA IR ELEKTROTECHNIKA,ISSN 1392-1215,VOL.19,NO.3,2013. http://www.eejournal.ktu.lt/index.php/elt/article/viewFile/3696/2347
[9]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s.599-602
[10]. http://www.medicom.com.pl/?p=308









Recenzje