Początki chemii środowiska
 Streszczenie
StreszczenieProblem niedoboru magnezu i jego właściwości antagonistyczne do ołowiu wywołały braki tego pierwiastka we wszystkich elementach środowiska w tym także w organizmach żywych. Badanie tego procesu przyczyniło się do rozwoju nowej dziedziny chemii – chemii środowiska. Chemia ta zajmuje się opisem zjawisk chemicznych zachodzących w środowisku przyrodniczym, związana ona jest głównie z trzema elementami środowiska: atmosferą, hydrosferą oraz pedosferą, a także relacjami pomiędzy nimi. Chemia środowiska staje się obecnie nauką interdyscyplinarną i szybko rozwojową. Jednak jej początki rozpoczęły się lata temu, gdy zaobserwowano pierwszy raz ubytki magnezu w środowisku.
Słowa kluczowe: magnez, ołów, pierwiastki antagonistyczne
Wprowadzenie
Jednym z największych problemów naszej cywilizacji jest zmniejszenie zasobności w magnez. Problem ten znany już od 1978r. i został opisany przez prof. Juliana Aleksandrowicza, który stwierdził: „Znamieniem współczesnego świata jest stale obniżający się poziom jonu Mg2+” [1]. Problem ten ówcześnie jest słabo poznany i uświadamiany społeczeństwu. Zmniejszenie tych zasobów wynika z braku ochrony środowiska przyrodniczego.
Magnez jest ciągliwym, srebrzystobiałym metalem o małej gęstości (1,75 gxcm2). Właściwości chemiczne ma zbliżone do berylu i wapnia. Ze względu na to, że dość łatwo utlenia się na powietrzu podobny jest również do glinu – na jego powierzchni wytwarza się ochronna warstwa tlenku magnezu MgO. Proces ten można zatrzymać przez pasywację.
Magnez leży w grupie berylowców, stąd też jest bardzo reaktywny i w przyrodzie występuje tylko w postaci związków chemicznych. Nie należy do pierwiastków rzadko spotykanych. Ogromna rola magnezu w życiu odpowiada jego miejscu w przyrodzie. Jest on jednym z najważniejszych składników skorupy ziemskiej jako pierwiastek oraz w postaci tlenku magnezu. [2]
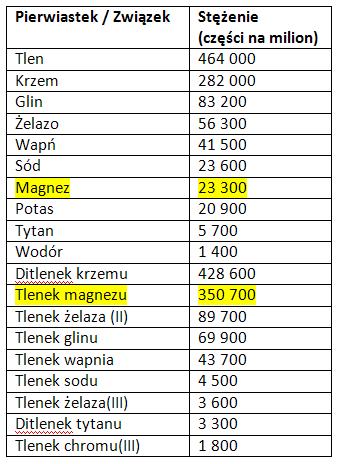
Tab. 1 Występowanie magnezu przyrodzie
Magnez po raz pierwszy został uznany za pierwiastek przez Josepha Blacka, zaś wyodrębniony w formie czystej w 1808 roku przez Humphry’ego Davy’ego. Nazwę magnez wprowadził Filip Walter.
Synergizm i antagonizm pierwiastków
Anatgonizm pierwiastków, czyli zmniejszenie oczekiwanego efektów danym procesie, w wyniku konkurencji spowodowanej właściwościami chemicznymi danego pierwiastka (promień jonowy, ładunek itp). Zjawisko to zachodzi pomiędzy jonami magnezu(II) i jonów ołowiu(II). Przeciwnym procesem jest synergia. Synergia pierwiastków to relacja pomiędzy co najmniej dwoma pierwiastkami, które w danym procesie zwiększają otrzymany efekt tego procesu.
Magnez – pierwiastek zdrowia
Magnez to pierwiastek biogenny, niezbędny do życia organizmów żywych, szczególnie roślin i zwierząt. Dla człowieka jest ważnym elementem diety. Należy do makroelementów, mimo to jego nadmiar również jest niekorzystny dlatego bardzo ważne jest przestrzeganie optymalnej dawki tego pierwiastka, która dla dorosłego człowieka wynosi 350 – 600 mg na dobę [3].
W ciele dorosłego człowieka jest od 25-35g magnezu (zawartość jak i zapotrzebowanie zmieniają się wraz z wiekiem Tab. 2), z czego znacząca większość (98%) w komórka a pozostała ilość w przestrzeni międzykomórkowej. Najbardziej zasobną tkanka w magnez jest tkanka łączna kostna (70%). Magnez jest również bardzo dobrym pierwiastkiem koordynującym i bardzo często występuje w obecności białek związany z nimi wiązaniami kowalencyjnymi i nie-kowalencyjnymi. W erytrocytach jest go znacznie więcej niż w osoczu. [4]
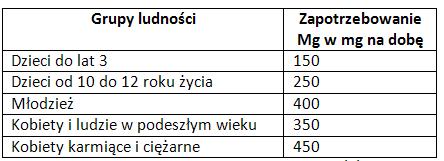
Tab. 2 Normy dzienne magnezu zalecane przez IŻiŻ
Magnez może występować w organizmie człowieka pod postacią różnych związków chemicznych:
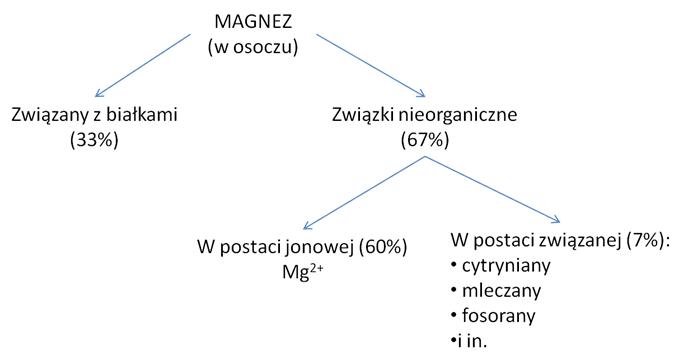
Rys. 1. Związki magnezu w organizmie ludzkim
Magnez jest bardzo ważnym pierwiastkiem z wielu powodów opisanych w literaturze [3, 4]. Do najważniejszych z nich zalicza się: aktywacja procesów enzymatycznych, bierze udział w przemianie cukrów, reguluje działanie wielu układów (np. nerwowego), ma właściwości ochronne (np. działa przeciw miażdżycowo, wpływa na tworzenie przeciwciał), jest antytoksykantem. Ogromne znaczenie posiada magnez w procesie fotosyntezy, gdyż jest pierwiastkiem wchodzącym w skład chlorofilu.
Gdzie zanika magnez?
Badania środowiskowe wykazały znaczny niedobór magnezu na wielu terenach Polski. Największy zaobserwowany niedobór tego pierwiastka występuje w województwie małopolskim [3, 4]. Ostanie badania wykazały, ze podobne zjawisko występuje na terenie całej Europy. Tym zjawiskiem jest tłumaczone zwiększona zachorowalność na choroby układu krążenia.
Dlaczego obniża się poziom Mg2+ w środowisku?
Jak wspomniano powyżej, magnez jest antagonistą wielu toksycznych pierwiastków, w tym ołowiu Pb, który został wprowadzony do środowiska w bardzo dużych ilościach zanim wprowadzono benzyny bezołowiowe. Skutek używania paliw ołowiowych jest zatem widoczny do dzisiaj w postaci niedoboru magnezu w glebie, a tym samym powodując niedobór tego pierwiastka w organizmach roślin i zwierząt (Rys. 2). W wyniku dużej zawartości ołowiu w glebie jest on pobierany przez rośliny, równie łatwo jak magnez. W ten sposób ołów staje się również elementem łańcucha pokarmowego. Trafiając także do organizmu ludzkiego.
Podsumowanie
Chemia środowiska, jest obecnie szybko rozwijającą się dziedziną, badającą przyczyny i mechanizmy różnych procesów zachodzących we wszystkich elementach środowiska. Dzięki niej odkryto, iż braki te można uzupełnić wykorzystując magnez zawarty w dolomitach (CaCO3• MgCO3), w tym bogate ich złoża znajdują się na terenie Polski. Magnez otrzymany z dolomitów posłużył do produkcji: nawozów, produktów spożywczych oraz farmacji. Należy dodać, że udział w badaniach tego zagadnienia mieli polscy chemicy.
Autor: Karolina Wójciuk
Literatura
[1] Z referatów „ Ochrona środowiska w nauczaniu i wychowaniu” pod redakcją M.R. Dudzińskiej i L. Pawłowskiego. Polit. Lubelska. Lublin 1993
[2] Napiórkowska B. Magnez właściwości, działanie, zastosowanie w lecznictwie. 2000. Warszawa
[3] Aleksandrowicz J., Janicki K. Pożywienie, woda i sól stołowa w ocenie zdrowia społecznego, Ossolineum, Wrocław 1978
[4] Graczyk A. Rola pierwiastków i metali toksycznych w funkcjonowaniu organizmu ludzkiego, Ekologiczna Sesja Dydaktyczna, WOM Koszalin 1993
http://laboratoria.net/home/14293.html








