ZESPÓŁ X – epidemia XXI wieku
 Prowadzone przez wiele lat obserwacje naukowców z całego świata dowodzą, że choroba stanowi epidemię XXI wieku. Rosnące tempo życia, niewłaściwa dieta oraz brak aktywności fizycznej zdecydowanie przyczyniają się do powstania zespołu metabolicznego. Charakteryzuje się on przede wszystkim współistnieniem otyłości brzusznej, zaburzeniem gospodarki węglowodanowej z insulinoopornością i hiperinsulinemią, dyslipidemią oraz nadciśnieniem tętniczym. Zespół metaboliczny jest jedną z najczęściej diagnozowanych chorób, dlatego warto znać jego etiologię, patogenezę oraz profilaktykę.
Prowadzone przez wiele lat obserwacje naukowców z całego świata dowodzą, że choroba stanowi epidemię XXI wieku. Rosnące tempo życia, niewłaściwa dieta oraz brak aktywności fizycznej zdecydowanie przyczyniają się do powstania zespołu metabolicznego. Charakteryzuje się on przede wszystkim współistnieniem otyłości brzusznej, zaburzeniem gospodarki węglowodanowej z insulinoopornością i hiperinsulinemią, dyslipidemią oraz nadciśnieniem tętniczym. Zespół metaboliczny jest jedną z najczęściej diagnozowanych chorób, dlatego warto znać jego etiologię, patogenezę oraz profilaktykę.Definicja i kryteria rozpoznawania zespołu metabolicznego
Na przestrzeni wielu lat definicja zespołu metabolicznego ewaluowała, wykazywano silny związek pomiędzy różnymi czynnikami metabolicznymi mającymi wpływ na jego powstanie.
Nie tylko zmieniała się definicja choroby wzbogacana o kolejne elementy, ale i jego nazwa od zespołu X do obecnie funkcjonującej zespołu insulinooporności, zespołu polimetabolicznego lub zespołu metabolicznego [3,1].
Zespół metaboliczny, to współistnienie powiązanych ze sobą czynników ryzyka pochodzenia metabolicznego, które inicjują rozwój choroby sercowo – naczyniowej i cukrzycy typu 2. Do powszechnie uznanych składowych zespołu zaliczamy: otyłość brzuszną, nadciśnienie tętnicze, hipertriglicerydemię, obniżone stężenie cholesterolu we frakcji HDL, insulinooporność, stan przedcukrzycowy (nieprawidłowa glikemia na czczo, IFG albo nieprawidłowa tolerancja glukozy, IGT) oraz cukrzycę typu 2 [4].
W tabeli 1 podano kryteria rozpoznania zespołu metabolicznego wg Międzynarodowej Federacji Diabetologicznej (IDF – International Diabetes Federation) [5].
Tabela 1. Kryteria rozpoznania zespołu metabolicznego wg IDF [5].
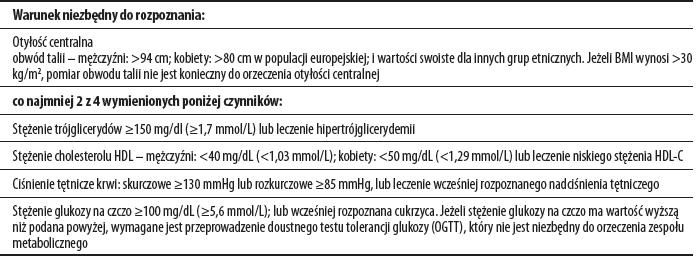
i adiponektyny w osoczu krwi, podwyższone wartości białka C – reaktywnego (CPR), cytokin prozapalnych oraz stężenia czynników krzepnięcia i fibrynolizy. Autorzy definicji IDF uważają, że wszystkie dodatkowe czynniki mające związek z wystąpieniem choroby powinny być uwzględniane podczas badań w celu weryfikacji ich wpływu na wystąpienie cukrzycy
i chorób sercowo – naczyniowych [5].
Jak wynika z doniesień naukowych zespół metaboliczny, to choroba o podłożu wielu współzależnych czynników, dlatego można się spodziewać dalszych badań nad wyznaczeniem najbardziej właściwych oraz dokładnych kryteriów jej rozpoznania [2,5].
Etiologia zespołu metabolicznego
Nieustannie naukowcy podejmują próbę określenie przyczyn powstania zespołu metabolicznego, zastanawiając się czy jego rozwój uzależniony jest od jednego czy od wielu czynników patogenetycznych. Należy zaliczyć do nich m. in.: otyłość/nadwagę, insulinooporność, cukrzycę typu 2, nadciśnienie tętnicze, okres życia płodowego, a także okres rozwoju psychofizycznego dzieci i młodzieży, proces starzenia i zaburzenia hormonalne. Niestety wszystkie czynniki odpowiedzialne za powstanie zespołu nie są jeszcze do końca poznane. Jednak bez wątpienia można stwierdzić, że największy wpływ na etiologię choroby ma otyłość brzuszna oraz insulinooporność [6,4,9].
Uważa się, że za rozwój zespołu metabolicznego są odpowiedzialne czynniki genetyczne oraz środowiskowe. Należy zwrócić szczególna uwagę na różnorodność populacyjną pod względem podłoża genetycznego oraz odmienną ekspresję genów w odpowiedzi na czynniki środowiska (rys. 1). Do czynników genetycznych zaliczamy postacie polimorficznych genów, których ekspresja prowadzi do wystąpienia otyłości, zaburzeń ze strony gospodarki węglowodanowej i insulinooporności oraz nadciśnienia tętniczego. Tak więc zespół metaboliczny jest uwarunkowany wielogenowo. Natomiast na czynniki środowiskowe składa się m. in.: niedożywienie płodu w całym okresie życia płodowego, zaburzenia organogenezy (przede wszystkim tkanki tłuszczowej), serca, układu wyspowego trzustki,, a także układu naczyniowego. Do kolejnych czynników środowiska należy zaliczyć dzisiejszy tryb życia,
a co się z tym wiąże niewłaściwą dietę, bogatą w żywność wysokokaloryczną i przetworzoną oraz brak aktywności ruchowej [9,6].
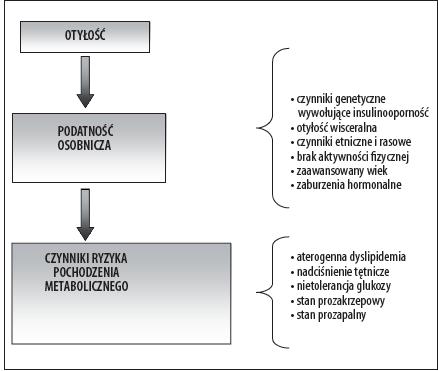
Rysunek 1. Czynniki ryzyka rozwoju zespołu metabolicznego [6]
Patogeneza zespołu metabolicznego – mechanizmy molekularne odpowiedzialne za insulnooporność i procesy zapalneNajnowsze badania dowodzą, że otyłość wisceralna, poprzedza rozwój insulonooporności oraz pozostałych czynników zespołu metabolicznego, czego konsekwencją są powikłania w postaci cukrzycy typu 2 i chorób sercowo – naczyniowych (rys. 2) [6].Jednym z czynników zespołu metabolicznego jest insulinooporność, która uczestniczy w patogenezie chorób układu krążenia, nadciśnienia tętniczego, zaburzenia gospodarki lipidowej, czynności śródbłonka, nadkrzepliwość, czy wystąpienie czynników i rozwój powikłań naczyniowych cukrzycy, typu makroangiopatii.
Insulinooporność dzielimy na:
• przedreceptorową
• receptorową
• poreceptorową.
W badaniach diagnostycznych bardzo ważne jest wczesne wykrycie stanów zaburzenia gospodarki węglowodanowej w tym cukrzycy, gdyż daje to szansę na modyfikację czynników patogenezy choroby, zapobiegając makroangiopatii. Insulinooporność, to przede wszystkim zdolność insuliny do mobilizowania zużycia glukozy przez tkanki obwodowe organizmu, a szczególnie mięśnie szkieletowe [4].
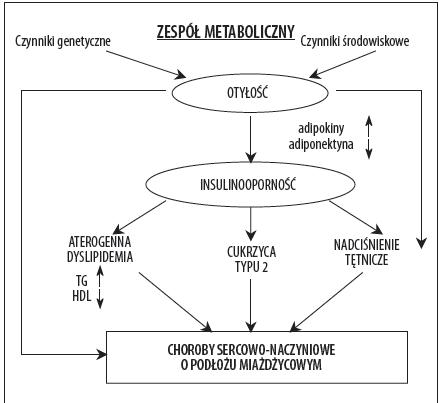
Rysunek 2. Czynniki patogenetyczne i następstwa zespołu metabolicznego [6]
Jak donoszą badania naukowe insulinowrażliwość stwierdzono już na poziomie adipocytów.
W adipocytach insulinooporność
prowadzi do nasilenia lipolizy, natomiast zwiększone stężenie wolnych kwasów
tłuszczowy osłabia wrażliwość komórek mięśni szkieletowych na insulinę, co
skutkuje zwiększeniem produkcji glukozy w wątrobie i nasila lipotoksyczność.
W ostatnim okresie czasu stwierdzono, że tkanka tłuszczowa jest aktywnym
narządem wewnątrzwydzielniczym o charakterze endokrynnym i parakrynnym,
produkującym wolne kwasy tłuszczowe, a także szereg białek – adipocytokin o zróżnicowanej aktywności biologicznej. Cytokiny prozapalne są czynnikiem
rozwoju miażdżycy i ostrych zespołów wieńcowych w tym zawału serca. Zaliczamy
do nich: leptynę, rezystynę, adiponektynę, interleukinę 6 (IL-6), czynnik
transformujący wzrost β (TGF- β), czynnik martwicy guzu α (TNF-α), inhibitor
aktywatora plazminogenu 1 (PAI-1), adipsyna, angiotensynogen, metallotioneina,
czy białko stymulująca acetylacje. Należy zauważyć, że białka wydzielane
i wytwarzane przez tkankę tłuszczową spełniają istotną rolę endokrynną w stanach fizjologicznych, odpowiadając za choroby i powikłania współtowarzyszące
otyłości, takie jak dysfunkcja śródbłonka, nadciśnienie tętnicze, miażdżyca
oraz insulinooporność.
Naukowcy twierdzą, że pierwotną przyczyną inicjującą rozwój insulinooporności
związanej
z otyłością jest stres oksydacyjny. Nadmiar napływających do komórek substratów energetycznych – wolnych kwasów tłuszczowy oraz glukozy, sprzyja powstaniu zwiększonych ilości acetylo-CoA, a co się z tym wiąże NADP w mitochondriach. Skutkiem powstania nadmiernych ilości NADP jest wzrost biosyntezy –ROS (reaktywnych form tlenu), a przede wszystkim anionu nadtlenkowego. Komórkowe mechanizmy broniące się przed
–ROS, usuwając wolne rodniki, w konsekwencji zmniejszają również dopływ substratów energetycznych, co skutkuje zaburzeniem działania sygnałów w obrębie receptorów insulinozależnych i powoduje insulinooporność [6].
Jak pokazują liczne badania
jednym z ważniejszych mechanizmów wywołujących insulinowrażliwość jest
zaburzenie komórkowego przekazywania sygnału insulinowego
w tkankach docelowych: adipocytach oraz mięśniach szkieletowych. W badanych
tkankach zaobserwowano zmniejszone wiązanie insuliny z jej receptorem, którego
przyczyną jest osłabiony proces fosforylacji receptora insulinowego i zmniejszenia jego aktywności
o charakterze kinazy tyrozynowej. W konsekwencji zmniejsza się fosforylacja białek substratowych receptora insulinowego. W patogenezie choroby istnieją również mechanizmy molekularne właściwe poszczególnym komórkom. Udowodniono, że w adipocytach osób
z zespołem metabolicznym, obniża się ekspresja białka IRS-1 i spada aktywność kinazy fosfatydyloinozytolu 3 (PI3K) związanej z IRS-1. Za inną przyczynę insulinooporności oraz upośledzonego transportu glukozy w adipocytach uważa się obniżenie ekspresji białka transportującego glukozę GLUT 4. Dowiedziono, że w komórkach mięśni szkieletowych ekspresja białka nie jest zakłócona, ale proces translokacji białka GLUT 4 do błony komórkowej [6].
W ostatnich latach prowadzone są intensywne badania eksperymentalne oraz kliniczne nad szlakami molekularnymi łączącymi stan zapalny z patogenezą insulinooporności występującej w zespole metabolicznym. Według wielu naukowców otyłość, to ogólnoustrojowy przewlekły stan zapalny, w którym dochodzi do aktywacji prozapalnych szlaków metabolicznych odpowiedzialnych za przekazywanie sygnałów do odpowiednich komórek organizmu. Skutkiem prowadzenia licznych doświadczeń naukowych było odkrycie, że za zakłócenie przekazywania sygnału przez receptor insulinowy odpowiedzialny jest szlak prozapalny kinazy-β IκB (IKK-β)/NF-ΚB oraz kinazy JNK1 (Jun kinase 1), potwierdzając hipotezę, że ich aktywacja jest zaangażowana w patogenezę rozwoju zespołu metabolicznego. Metaboliczne mechanizmy prowadzące do aktywacji kinaz JNK1 i IKK-β, dzielimy na receptorowe (aktywacja przez wiążące się ze swoimi receptorami cytokiny prozapalne, takie jak TNF-α lub interleukina 6) i pozareceptorowe (stres wewnątrzkomórkowy: nadmierna biosynteza –ROS oraz stres związany z retikulum endoplazmatycznym) [6].
Za ogniwo łączące otyłość, insulinooporność i cukrzycę typu 2 uważa się adipocytokiny, hormony peptydowe, które są uwalniane z adipocytów (rezystyna, leptyna, interleukina 6, adiponektyna, TNF-α, PAI-1) [4].
Istotną rolę odgrywającą w mechanizmach patogenetycznych zespołu metabolicznego posiada rezystyna. To
bogaty w cysteinę polipeptyd wytwarzany przez komórki tłuszczowe. Doniesienia
naukowe potwierdzają, że ekspresja rezystywny dodatnio koreluje z insulino-
opornością. W genie rezystyny występują swoiste polimorfizmy, które w istotny
sposób wiążą się z opornością tkanek na insulinę oraz jej konsekwencjami na
poziomie komórkowym. Naukowcy odkryli rezystynę w 2001 r., nie poznano jeszcze
do końca wszystkich mechanizmów działania tej adipokiny, dlatego ciągle trwają
prace badawcze nad jej rolą
w inicjowaniu zespołu X [6].
Kolejnym czynnikiem
odpowiedzialnym za rozwój insulinooporności u otyłych ludzi jest leptyna.
Leptyna, to hormon, którego rolą jest utrzymanie prawidłowej masy ciała w okresie przekarmienia. Działanie leptyny uzależnione jest od receptorów
znajdujących się
w podwzgórzu. U osób z zespołem metabolicznym stwierdzono podwyższone stężenie
leptyny w surowicy krwi, na podstawie czego stwierdzono występowanie stanu
oporności na działanie hormonu. Niestety mechanizm powstania leptynooporności
nie jest do końca poznany, są jedynie przypuszczenia, że jest to skutek
zakłócenia przekazywania sygnału przez leptynę albo nieefektywny transport
przez barierę krwe-mózg. Innym powodem oporności na leptynę może być zwiększony
napływ wolnych kwasów tłuszczowych do tkanek. Naukowo udowodniono, że leptyna
nasila procesy metaboliczne m.in. β-oksydację lipidów, hamując ich biosyntezę w mięśniach szkieletowych i komórkach β trzustki, podtrzymując w ten sposób
wrażliwość na insulinę.
Następnym mediatorem istotnym w diagnozie zespołu metabolicznego jest białko syntetyzowane w tkance tłuszczowej – adiponektyna. Następstwem jej działania receptorowego jest zwiększenie wrażliwości komórek organizmu na insulinę. Molekularny mechanizm odpowiedzialny za obniżenie stężenia adiponektyny w zespole X nie jest do końca poznany. Istnieją jedynie spekulacje, że czynnikiem hamującym ekspresję adiponektyny jest komórkowy stres oksydacyjny. Udowodniono również, że insulina wprost proporcjonalnie do czasu i dawki ekspozycji hamuje ekspresję genu adiponektyny. Potwierdzeniem tezy, że czynniki genetyczne stanowią istotna rolę w patogenezie zespołu metabolicznego jest występowanie swoistych polimorfizmów w genie adiponektyny. Opisano także działanie adiponektyny w uwrażliwianiu tkanek na działanie insuliny redukując napływ wolnych kwasów tłuszczowych do wątroby, zwiększając β-oksydację lipidów oraz hamując syntezę glukozy w wątrobie. Natomiast w komórkach mięsni szkieletowych adiponektyna inicjuje zużytkowanie glukozy i proces β-oksydacji. Opisane mechanizmy molekularne odpowiedzialne za powyższe działanie mediatora jest prawdopodobnie zwiększona fosforylacja receptora insulinowego, a także aktywacja białkowej kinazy aktywowanej AMP w wątrobie oraz w komórkach mięśni szkieletowych [6].
Innym mediatorem uczestniczącym w mechanizmach molekularnych prowadzących do rozwoju zespoły X, a co się z tym wiąże insulinooporności jest czynnik martwicy nowotworów TNF-α. W wielu pracach badawczych opisano hamowanie przekazywania sygnału insulinowego przez TNF-α poprzez aktywację kinaz serynowych białek substratowych receptorów insulinowych IRS-1 oraz IRS-2. Na działanie receptora insulinowego o aktywności kinazy tyrozynowej niekorzystnie wypływają zamienione w ten sposób białka IRS, które w konsekwencji ulegają degradacji.
Kolejny mediator
insulinowrażliwości, to interleukina 6. Stężenie IL- 6 dodatnio koreluje
z BMI, stężeniem wolnych kwasów tłuszczowych i ilością tkanki tłuszczowej w organizmie. Mediator ten wpływa na insulinooporność, hamując aktywność lipazy
lipoproteinowej oraz pobudzając oś podwzgórze – przysadka – nadnercza. Do
jednych z najważniejszych działań IL-6 inicjujących insulinooporność jest
osłabienie sygnału insulinowego w tkankach obwodowych, wynikającego z obniżenia
ekspresji cząsteczek sygnalizacyjnych powiązanych z receptorem insulinowym oraz
niekorzystny wpływ na działanie leptyny i obniżanie wydzielania adiponektyny
[4].
Najnowsze doniesienia naukowe opisują występowanie białka receptorowego tanis, którego stężenie najprawdopodobniej może być nieprawidłowe u osób z hiperglikemią. Białko receptorowe tanis odpowiada za regulowanie ośrodkiem sytości i łaknienia oraz wrażliwością na insulinę. Istnieją przypuszczenia, że to białko receptorowe stanowi jeden z czynników powiązania insulinooporności i cukrzycy typu 2 z chorobami układu sercowo – naczyniowego
Wyniki wielu badań epidemiologicznych i klinicznych wskazują na ścisłe powiązanie między otyłością wisceralną, a insulinoopornością, stanem prozapalnym istotnie zwiększającym ryzyko wystąpienia zespołu metabolicznego [4,6].
Profilaktyka
W XXI wieku zaobserwowano tendencję do spożywania znacznych ilości sodu oraz kalorii pochodzących z węglowodanów prostych i nasyconych kwasów tłuszczowych. Za to zmniejszyło się spożycie żywności bogatej w witaminy, składniki mineralne, błonnik pokarmowy i niezbędnych nienasyconych kwasów tłuszczowych (NNKT). Ogromny postęp cywilizacyjny doprowadził również do zmniejszenia aktywności fizycznej u dorosłych jak
i dzieci. Niestety wszystkie wymienione czynniki przyczyniły się do rozwoju otyłości, hiperlipidemii, cukrzycy, dyslipidemii, nadciśnienia tętniczego, choroby niedokrwiennej serca, co w konsekwencji jest przyczyną powstania epidemii zespołu metabolicznego [3,8].
Do niefarmakologicznej prewencji zespołu metabolicznego zaliczamy przede wszystkim modyfikację stylu życia. Profilaktyka w zespole powinna obejmować następujące działania:
- monitorowanie wskaźnika masy ciała BMI, obwodu brzucha, glikemii oraz ciśnienia tętniczego
- redukcję nadmiaru masy ciała (minimum 10% w ciągu pierwszych 12 miesięcy leczenie, poprzez stosowanie odpowiedniej diety z ograniczeniem kalorii), a także utrzymywania jej na odpowiednim poziomie
- unikanie spożywania tłuszczy nasyconych (trans), znajdujących się m. in. w żywności pochodzenia zwierzęcego (masło, tłuste gatunki mięs), słodyczach (ciastka, batony), daniach typu fast food na korzyść NNKT zawartych w mięsie ryb, olejach roślinnych
- wyeliminowanie z diety produktów o wysokim indeksie glikemicznym, zawierających węglowodany proste (słodycze, przekąski, cukier, płatki śniadaniowe), zastępując je produktami które dostarczają węglowodanów złożonych, witamin, składników mineralnych i błonnika (np.: pełnoziarniste pieczywo, kasze)
- ograniczenie spożycie alkoholu oraz soli
- zwiększenie spożycia warzyw i owoców, które dostarczają niezbędnych witamin, składników mineralnych oraz błonnika pokarmowego
- zapewnienie systematycznej aktywności fizycznej
- unikanie stosowania leków powodujących uboczne proaterogenne zaburzenia metaboliczne [9,7].
U pacjentów szczególnie zagrożonych wystąpieniem chorób układu krążenia i cukrzycy typu 2, a także u chorych na miażdżycę i cukrzycę oprócz modyfikacji stylu życia powinno rozważyć się leczenie farmakologiczne. W zespole metabolicznym postępowanie terapeutyczne ma na celu leczenie otyłości, insulinooporności, dyslipidemii oraz nadciśnienia tętniczego. Dlatego farmakoterapia zespołu X najczęściej obejmuje stosowanie leków zwiększających wrażliwość na insulinę – metforminy i tiazolidynediony. Innymi lekami stosowanymi podczas terapii są fibraty i statyny, które zmniejszają nasilenie dyslipidemii
oraz leki obniżające ciśnienie krwi [7].
Zespół metaboliczny, to choroba
na którą składa się wiele czynników: otyłość centralna, hiperinsulinomia,
insulinooporność, dyslipidemia i nadciśnienie tętnicze, są one przyczyną
rozwoju zmian miażdżycowych, choroby niedokrwiennej serca oraz cukrzycy typu 2.
Z tego powodu zespół metaboliczny stał się epidemią XXI wieku i jednym z największych wyzwań w programach zdrowia publicznego na świecie. Dlatego tak
ważne jest, aby zadbać
o właściwą edukację zdrowotną i żywieniową dostosowaną do szerokiej grupy
odbiorców.
Bardzo istotnym elementem profilaktyki w zespole metabolicznym jest modyfikacja dotychczasowego stylu życia. Przede wszystkim należy stosować odpowiednio zbilansowaną dietę, która dostarcza wszystkich niezbędnych składników odżywczych, przestrzegać wszystkich zaleceń żywieniowych, utrzymywać odpowiednią masę ciała oraz wdrożyć
w życie codzienną aktywność fizyczna.
autor: Natalia Litwa
http://laboratoria.net/home/16111.html








