Nowotwory: renesans RAS
Trzydziestoletni pościg za substancjami niszczącymi jedne z najbardziej śmiercionośnych rodzin protein wywołujących nowotwory nie przyniósł rezultatów. Niektórzy naukowcy podejmują jednak kolejną próbę.
Laguna Design/SPL
Kiedy Stephen Fesik opuścił przemysł farmaceutyczny aby założyć laboratorium mające odkrywać nowe leki, stworzył listę pięciu najważniejszych rakotwórczych protein znanych nauce. Te proteiny powodują rozrost guza i okazują się być zmorą producentów leków- są zbyt gładkie i wiotkie, aby związać z nimi substancje lecznicze i tym samym zablokować.
Jednym z pierwszych winowajców, którzy znaleźli się na liście Fesika była rodzina białek zwanych Ras. Od ponad 30 lat wiadomo, że mutacje w genach kodujących białka Ras znajdują się wśród najbardziej niebezpiecznych czynników wywołujących nowotwory. Mutacje Ras odnaleźć można w najbardziej agresywnych i śmiertelnych nowotworach, w tym w 25% nowotworów płuc i 90% nowotworów trzustki. W zaawansowanych nowotworach, guzy z mutacjami Ras wywołują wcześniejszą śmierć niż guzy bez nich.
Dekady badań nie przyniosły jeszcze leku, który zahamowałby działanie Ras. Poprzednie porażki odstraszyły naukowców i zmusiły firmy farmaceutyczne do porzucenia zaawansowanych projektów. Jednak laboratorium Fesika przy Vanderbilt University w Nashville i kilka innych grup badawczych ponownie zwraca swoje oczy ku tym proteinom. Uzbrojeni są w nowe technologie i lepsze rozumienie tego, jak działają te białka. W zeszłym roku, amerykański National Cancer Institute rozpoczął Inicjatywę Ras, czyli 10-milionowy projekt mający na celu znalezienie sposobów na leczenie nowotworów wywoływanych przez Ras. Z kolei naukowcy odkrywają już związki, które mogłyby wejść w skład pierwszych leków namierzających białka Ras.
Naukowcy biorą pod uwagę to, że w wyścigu mają przed sobą jeszcze wiele płotków do przeskoczenia. „Trzeba mieć wiele szacunku do Ras”, mówi Troy Wilson, prezes Wellspring Biosciences, firmy z La Jolla w Kaliforni, która powstała w 2012 roku z myślą o Ras. „Nie można ich lekceważyć, to jedne z najważniejszych genów nowotworowych”.
Zwolennicy renesansu Ras mówi, że jakiekolwiek oznaki sukcesu mogą pokazać jak namierzyć inne ważne białka, na które do tej pory nie ma leków. „To, że ludzie uważają, że białka Ras są niemożliwe do leczenia, nie oznacza, że naukowcy powinni się poddać”, mówi Channing Der, badacz nowotworów z University of North Carolina w Chapel Hill.
W 1982 roku grupa Dera była jedną z pierwszych, które pokazały, że mutacje w ludzkich genach kodujących Ras mogą wywoływać nowotwory. To odkrycie wywołało pościg za genami nowotworowymi w ludzkim genomie. Wcześniej były one opisywane jedynie w przypadku wirusów i modeli zwierzęcych. Odkrycie położyło też fundamenty współczesnych badań nad nowotworami, z naciskiem na poszukiwanie mutacji genetycznych i zmodyfikowanych ścieżek molekularnych. Co więcej, dało nadzieję na wynalezienie leków niszczących geny nowotworowe i tym samym leczących niektóre nowotwory.
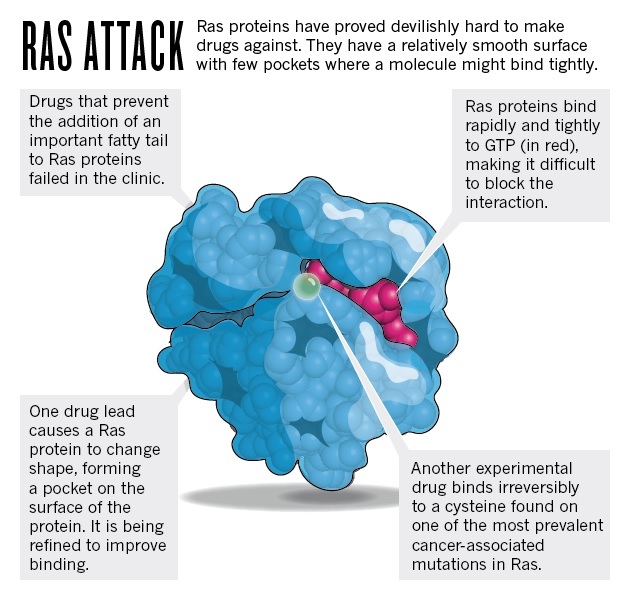
Następne lata były przesiąknięte odkryciem. Stało się jasne, że ludzie produkują trzy bardzo podobne białka Ras, które są aktywowane gdy komórki się namnażają (na przykład aby zastąpić uszkodzoną tkankę). Sygnały spoza komórki uruchamiają białka Ras, które wiążą się z molekułą zwaną GTP. Rakotwórcze formy Ras nie potrafią przejść ponownie w stan dezaktywacji i w efekcie nie potrafią poprawnie przetwarzać GTP. Wydawało się więc logicznym, by szukać leków działających na wiązanie GTP aby zatrzymać zmutowane Ras.
Jednak w miarę jak zrozumienie biochemii Ras rosło, wraz z nim rósł także pesymizm. Koligacja Ras z GTP okazała się nadzwyczaj duża, a odnalezienie innego związku, który blokowałby dostęp do GTP wydawało się niemożliwe. Białka Ras wchodzą też w interakcje z innymi białkami, jednak leki o małych molekułach, które są w stanie dostać się do wnętrza komórek są często zbyt małe, by otoczyć szeroką powierzchnię interakcji międzybiałkowych. (Przeciwciała potrafią z kolei maskować duże obszary, ale większość nie penetruje błon komórkowych.)
Struktury Ras przysparzały więcej powodów do zmartwień. Producenci leków patrzą na kształt proteiny aby zmierzyć prawdopodobieństwo znalezienia substancji, która zwiąże się z krytycznym obszarem. Szczególnie korzystny jest kształt białka z głębokimi „kieszeniami”, do których może dostać się lek i związać z białkiem w kilku miejscach. Jednak proteiny Ras są względnie gładkie.
Dwadzieścia lat temu, naukowcy sądzili przez chwilę, że rozwiązali ten problem. Do poprawnego funkcjonowania, proteiny Ras potrzebują zahaczyć się o wnętrze błony komórkowej specjalnym ogonkiem. Ogonek ten jest dodawany przez transferazę- enzym, który łatwiej namierzyć lekami niż proteinę. Pomysł więc polegał na upośledzeniu aktywności Ras przez wynalezienie inhibitorów transferazy.
Na pierwszy rzut oka wyglądało to na bardzo dobrą strategię. Inhibitory wywołały spadek namnażania się komórek nowotworowych u myszy i ludzi. Do początku XXI wieku już sześć firm farmaceutycznych chciało wprowadzić leki na rynek. Wiele z nich porzuciło inne projekty związane z Ras, bo problem wydawał się być rozwiązany, mówi chemik Herbert Waldmann z Instytutu Fizjologii Molekularnej Maxa Plancka w Dortmundzie. „Cała branża wzięła głęboki wdech i czekała”, wspomina.
Trzy formy ludzkich białek Ras są niemal identyczne jeśli chodzi o strukturę i sekwencję aminokwasową. Naukowcy założyli, że ich funkcje też będą identyczne. Większość narzędzi wykorzystywanych do badania Ras- kultury komórkowe, transgeniczne myszy oraz przeciwciała, były tworzone z wykorzystaniem H-Ras, najprostszej do tego celu formy Ras. „Wszyscy z nas, łącznie ze mną, nie chcieli zaprzątać sobie głowy pracą z innymi formami, skoro wystarczyło badać tylko H-Ras”, mówi Der. „Niestety straciliśmy dużo pieniędzy na tym błędnym rozumowaniu.”
Okazało się bowiem, że pozostałe dwie formy Ras: K-Ras oraz N-Ras są zdecydowanie ważniejsze w kontekście nowotworu, a komórka ma plan awaryjny, który pozwala im dalej pracować. Inny enzym jest w stanie zastąpić transferazę, czyniąc eksperymentalne leki zupełnie bezużytecznymi.
Ten epizod pozostawił blizny na wszystkich zaangażowanych i upłynęło trochę czasu zanim naukowcy zechcieli dać białkom kolejną szansę. Mniej więcej dekadę później temat zaczął powracać. „Nagle ludzie odwracali się i mówili ‘hej, to wciąż jeden z najważniejszych działów onkologii, od dziesięciu lat nikt w nim nic nie zrobił. Zróbmy coś z tym’ ”, mówi Waldmann. Tym razem naukowcy zastosowali nowe podejście, patrząc na słabe punkty guzów wywoływanych przez Ras.
Jedną taką słabością jest „syntetyczna śmiertelność”. Kiedy proteiny Ras są na najwyższych obrotach, komórki nowotworowe, aby przetrwać, stają się zależne od innych ścieżek molekularnych. Zablokowanie tych ścieżek może nie mieć wpływu na zdrowe komórki, lecz zabić komórki nowotworu. Mając to na uwadze, laboratoria przygotowały się do poszukiwania odpowiednich syntetycznych ścieżek.
Efektem była fala artykułów opisujących potencjalne nowe cele poprzedzająca falę raportów, mówiących, że wyniki nie były możliwe do odtworzenia. W październiku zeszłego roku, William Sellers, szef działu onkologii w szwajcarskiej firmie produkującej leki Novartis, doniósł na konferencji, że wraz ze współpracownikami bezskutecznie próbowali odtworzyć najbardziej prominentne wyniki dotyczące syntetycznej śmiertelności w kontekście Ras. Niewielkie zmiany, na przykład typu komórek czy warunków podczas przeprowadzania badań, w łatwy sposób zmieniały rezultat eksperymentu, mówi Julian Downward, badacz nowotworów z Francis Crick Institute w Londynie. Naukowcy wciąż próbują przesiewać te wyniki w poszukiwaniu takich, które okażą się spójne, jednak Downward wątpi w pomyślność tych starań. „Każdy wydaje się otrzymywać różne wyniki z tego typu eksperymentów”, mówi, „podejrzewam, że nie odkryjemy w ten sposób nic bardzo istotnego.”
Szyte na miare
Po rozczarowaniu związanym z niepowodzeniem nowego podejścia, niektórzy naukowcy próbowali zaatakować same białka Ras. „Zdecydowaliśmy się zadziałać bezpośrednio na Ras”, mówi Brent Stockwell, biolog chemiczny z Columbia University w Nowym Jorku.
Postępy uczynione w ostatnich pięciu latach w zakresie modelowania komputerowego i poszukiwania związków, dają nową nadzieję na namierzanie gładkich struktur protein Ras, mówi Stockwell. Naukowcy są teraz w stanie lepiej przewidzieć podobieństwo małych molekuł do protein i lepiej rozumieją dynamikę białek.
Współpracownicy Stockwella bazują na tym, aby zaprojektować małe molekuły dopasowane idealnie do powierzchni Ras- najpierw na komputerze, a następnie w laboratorium. „Może dla tych konkretnych białek nie da się znaleźć odpowiedniego rozwiązania nigdzie na świecie”, mówi Stockwell, „może po prostu trzeba je stworzyć.”
Fesik także tworzy nowe leki, jednak zaczyna od zbioru istniejących związków. Podczas swojej poprzedniej kariery w Abbott Laboratories w Abbott Park (Illinois), Fesik opracował metody zakłócania interakcji pomiędzy proteinami poprzez łączenie fragmentów związków, które wiążą się, choć słabo, z celem. W rezultacie otrzymał duży związek, którego nie znajdzie się raczej w standardowych zbiorach chemicznych.
Fesik porównuje tę technikę, zwaną „fragment-based screening” do tworzenia klucza do odpowiedniego zamka poprzez wycinanie jednego rowka na raz. „W końcu wszystkie rowki łączą się w całość”, mówi, „związek jest czymś nowym, a powstaje przez powolne i stopniowe dopasowywanie go do danej proteiny.”
Laboratorium Fesika i jego przemysłowi współpracownicy odnaleźli ponad 130 molekuł, które słabo wiążą się z K-Ras. Związki zmieniają strukturę proteiny, otwierając w niej swego rodzaju „kieszeń”. Naukowcy starają się teraz dodawać nowe fragmenty, aby poprawić dopasowanie. Der zauważa, że Fesik zdobył reputację w tworzeniu leków zanim jeszcze zdecydował się rozwijać karierę akademicką. „Jeśli komukolwiek się uda, to będzie to Fesik”, mówi.
Inni przyglądają się możliwościom wykorzystania konkretnych mutacji w obrębie K-Ras. Choć istnieje wiele różnych mutacji związanych z genem kodującym, tylko trzy z nich są odpowiedzialne za znaczną większość nowotworów. Każda z nich obejmuje enzym o nieco innym zachowaniu, mówi Der. „Jeśli zaczniemy myśleć o różnych mutacjach jako o posiadaniu różnych osobowości, to mogą one ujawnić unikalne słabości”, mówi.
Kevan Shokat, biology chemiczny z University of California w San Francisco, przyłączył się do poszukiwań sześć lat temu. W 2013 roku odkrył związek, który namierza mutację K-Ras znaną jako G12C. Mutacja ta występuje w około 20% nowotworów płuc i zamienia aminokwas glicynę na cysteinę, która z łatwością reaguje z innymi molekułami. Związek Shokata wykorzystuje reaktywną cysteinę i łączy się z nią nieodwracalnie. Inhibitor będzie wymagał dodatkowej obróbki zanim zostanie użyty u pacjentów, jednak jako pierwszy potencjalny lek, który wiąże się bezpośrednio z Ras, wywołał ogromną falę ekscytacji, mówi Downward. „Dodał energii wszystkim zaangażowanym w poszukiwania”, dodaje.
Shokat mówi, że od dłuższego czasu uważał, że działanie na konkretne mutacje może przynieść dobre rezultaty, jednak do niedawna wahał się czy sprawdzić swój pomysł w laboratorium. Producenci leków obawiali się substancji, które trwale łączą się ze swoim celem, bo wydają się one bardziej skłonne do wchodzenia w reakcje w innymi proteinami w ciele. Jednak ostatnio odkryto kilka niezwykle udanych leków o tej własności, wśród nich na przykład ibrutinib.
W międzyczasie firmy farmaceutyczne są coraz bardziej otwarte na pomysł tworzenia leków, które działają u tych pacjentów z nowotworami, którzy są nosicielami konkretnych mutacji. „Nie będzie jednego leku, który zadziała u każdego pacjenta z K-Ras”, przewiduje Timothy Burns, badacz nowotworów z University of Pittsburgh w Pensylwanii.
Fesik mówi, że rozwiązania zagadki Ras, jakiekolwiek są, prawdopodobnie powstaną w instytucjach akademickich. Porzucił działalność w farmacji właśnie dlatego, że uwielbiał pościg za ważnymi celami, nieważne jak łatwo czy trudno jest je namierzyć. Pogoń za trudną do namierzenia proteiną ciężko jest uzasadnić w przemyśle, gdzie cele naukowe muszę często ustępować krótkoterminowej możliwości zysku. „Większość firm farmaceutycznych nie chce podejmować ryzyka, a jeśli nawet je podejmują, to tylko krótkotrwale”, mówi.
Powstają jednak mosty łączące te dwa światy. Laboratorium Fesika weszło w partnerstwo z niemiecką firmą farmaceutyczną Boehringer Ingelheim, aby ocenić swój pierwszej generacji lek namierzający Ras. Z kolei Shokat został współzałożycielem Wellspring Biosciences, by wprowadzić swój inhibitor na rynek. Projekt niedługo po tym uzyskał wsparcie ze strony Janssen Biotech z Pensylwanii.
Wysiłki doczekały się także uwagi ze strony rządowej. Wielomilionowa Inicjatywa Ras wspiera rozwój narzędzi i podstawowych badań nad strukturami białek Ras, aby umożliwić wynalezienie odpowiednich leków, mówi Frank McCromick, badacz nowotworów z University of California w San Francisco. „Próbujemy zniwelować złą reputację Ras jako celu naukowego, aby więcej osób zechciało ponownie się nimi zająć”, mówi.
Od lat przemysł farmaceutyczny zajmował się łatwiejszymi celami w różnych kategoriach protein zwanych kinazami, mówi McCormick. Spowodowało to powstanie wielu udanych leków przeciwko nowotworom. Jednak ta fala powoli odchodzi i czas skupić się na celach trudniejszych, jak na przykład kluczowe w tej tematyce białka Ras.
Stockwell ma nadzieję, że ponowne zainteresowanie wokół Ras skłoni naukowców do badania innych trudnych celów. „Jeśli tu udaje odnieść się jakiś sukces, to może przełoży się on na inne cele”, mówi, „jeśli naprawdę chcemy walczyć z chorobami, to musimy pamiętać o ogromnej liczbie dodatkowych celów do namierzenia.”
Źródło: http://www.nature.com/news/cancer-the-ras-renaissance-1.17326
Tagi: ras, proteina, nowotwor, enzym, mjtacja, transferaza, białko, trzustka
wstecz Podziel się ze znajomymi








