Tworzenie enzymów bionicznych
Co w związku z tym? Stworzono sztuczne enzymy mogące katalizować reakcje nawet w procesach, w których siły natury nigdy nie tworzyły katalizatorów (Nature, "Niebiologiczna kataliza wymuszana działaniem białek z grupami hemowymi zawierającymi metale szlachetne w miejscach żelaza").
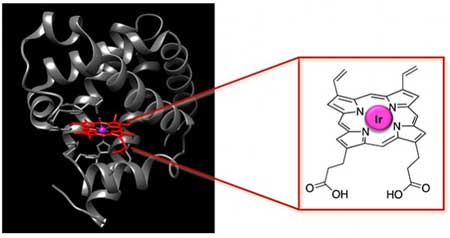
Fotografia zawiera obraz sztucznego metaloenzymu (enzymu zawierającego metal). W strukturze białka (szare) znajduje się porfiryna (czerwona), czyli komponent naturalnego białka z grupą hemową, w którym naukowcy dokonali wymiany żelaza na iryd w charakterze aktywnego środowiska (różowe). (Fotografia: John Hartwig, Lawrence Berkeley/UC Berkeley)
Tworząc enzymy sytnetyczne, zespół wyznaczył nowe granice dla projektowania katalizatorów, które łączą wytrzymałość katalizatorów biologicznych i chemicznych. Łączenie tych wytrzymałości stwarza warunki do operowania różnorodnymi dziedzinami chemii, których nie można zastosować rozdzielnie z wykorzystaniem klasycznych kompleksów biologicznych lub chemicznych. Niniejsze badanie może wspomagać redukcję kosztów, czasu lub odpadów otrzymywanych w przemysłowych reakcjach chemicznych podczas produkcji biopaliw, paliw kopalnych, itp.
Enzymy, które zawierają jony metali, czyli metaloenzymy, posiadają reaktywność centrum przemiany metalicznej oraz potencjał wydzielania molekularnego enzymów. Wcześniej, dzięki zastosowaniu inżynierii molekularnej, naukowcy rozszerzyli zakres reakcji katalizowanych działaniem naturalnie występujących metaloenzymów w celu wywoływania reakcji nie występujących w naturze.
Należy pamiętać, że niniejsza strategia pozostaje ograniczona reaktywnością centrum metalu w naturalnych metaloenzymach. Aby pokonać to ograniczenie, naukowcy z Lawrence Berkeley National Laboratory oraz University of California w Berkeley dokonali podstawienia naturalnego żelaza z metaloenzymu irydem, który zachowuje się inaczej niż żelazo.
W wyniku tego otrzymano enzymy sztuczne na cel prowadzenia katalizy niebiologicznej w naturalnym wiązaniu enzymu nadającego się do wykorzystania w procesie wydzielania się w warunkach laboratoryjnych. Sztuczne enzymy zapewniają reaktywność określonych molekuł przy zachowaniu wysokiego stopnia selektywności.
Z naukowego punktu widzenia, naukowcy dokonali wymiany żelaza w kompleksie żelazowo – porfirynowym mioglobiny na metal szlachetny – iryd - w celu utworzenia enzymów, które będą katalizowały reakcje i które nie są katalizowane działaniem naturalnych enzymów żelaznych lub innych metaloenzymów. Zespół badawczy dokonał modyfikacji niniejszych sztucznych enzymów w celu katalizowania znacznej ilości reakcji, przede wszystkim konwersji wiązań węglowodorowych do wiązań węgiel-węgiel, co czyni je pierwszymi enzymami w katalizie tego typu reakcji.
Zaprezentowana metoda tworzenia sztucznych białek z grupami hemowymi zawiera abiologiczne porfiryny metaliczne co stanowi kolejny etap w otrzymywaniu sztucznych enzymów z niemalże nieograniczonych kombinacji struktur porfirynowo – białkowych oraz sztucznych kofaktorów metali.
Niniejsze enzymy syntetyczne mogą katalizować szeroki wachlarz transformacji niebiologicznych. Ponadto, stanowiąc część kolejnych opracowań, zespół ten zdołał udoskonalić enzymy bioniczne w celu łączenia wielkości odkrytych w enzymach naturalnych.
Źródło: http://www.nanowerk.com/news2/biotech/newsid=45774.php
http://laboratoria.net/naturecom/26816.html








