Zabójcze limfocyty T przedstawiają swoją dobroduszną stronę
Układ odpornościowy spełnia trudną funkcję przywracania równowagi. Musi szybko reagować na niebezpieczne mikroorganizmy, które zagrażają gospodarzowi, a jednocześnie pokojowo współistnieć z licznymi mikroorganizmami kolonizującymi stanowiące bariery powierzchnie, takie jak skóra i jelito. W publikacji Cell, Linehan i wsp. badają interakcje między komórkami układu odpornościowego a bakterią, która normalnie znajduje się na skórze i identyfikują szlak sygnalizacyjny, który reguluje odpowiedź immunologiczną na takie mikroorganizmy.
ÂÂ
Staphylococcus epidermidis należy do grupy mikroorganizmów nazywanych komensalami i zazwyczaj kolonizuje ludzką skórę bez wywoływania chorób. Jednak w przypadku wcześniaków i osób w stanie immunosupresji lub które przechodziły implantację endoprotez stawów, S. epidermidisÂÂ może wywołać ciężką chorobę lub przewlekłą infekcję2. Co więcej, pomimo tego, że bakteria jest na ogół nieszkodliwa, nie jest ona ignorowana przez układ odpornościowy. W przypadku skóry myszy odpowiedź na pierwsze spotkanie z niektórymi szczepami S. epidermidis jest zdominowana przez typ komórek immunologicznych zwany limfocytami T cytotoksycznymi typu CD8+, znanych również jako limfocyty-zabójcy (NK – natural killer – z ang. „naturalni zabójcy”). Linehan i współpracownicy zadali dwa kluczowe pytania dotyczące tej reakcji, a uzyskane przez nich odpowiedzi okazały się bardzo pouczające.
Pierwsze pytanie brzmiało: jak limfocyty T rozpoznają S. epidermidis? Uważa się, że odpowiedź na bakterie może wystąpić, gdy limfocyt T rozpozna fragment peptydu bakteryjnego związany z "klasycznym" składnikiem białkowym klasy Ia głównego kompleksu zgodności tkankowej (ang. major histocompatibility complex - MHC), który prezentuje takie fragmenty komórkom układu odpornościowego. Jednak korzystając z modelu myszy, Linehan i jego koledzy stwierdzili, że "nieklasyczne" białko, H2-M3, należące do rodziny MHC klasy Ib, zamiast tego było zaangażowane w prezentację MHC w odpowiedzi na S. epidermidis. H2-M3 może zawierać peptydy bakteryjne, w których reszta aminokwasowa metioniny została zmodyfikowana przez dodanie grupy N-formylowej.
Inne pytanie, na które starano się odpowiedzieć stanowiła kwestia czy ten nieklasyczny szlak rozpoznawania w układzie odporności może wiązać się również z "niekonwencjonalnym" zachowaniem limfocytów T. Zespół badał to poprzez porównywanie wzorów ekspresji genów limfocytów CD8+ T reagujących na S. epidermidis z innymi typami populacji limfocytów T na skórze myszy, które nie reagują na bakterię. Stwierdzono, że limfocyty T CD8+ eksprymowały geny związane z gojeniem ran i naprawą tkanek (Ryc. 1). Było to zaskakujące, ponieważ oczekiwano, że reagujące limfocyty T CD8+ będą eksprymować geny związane z aktywacją szlaków zaangażowanych w zabijanie niechcianych komórek lub uwalnianie prozapalnych cząsteczek sygnałowych.
ÂÂ
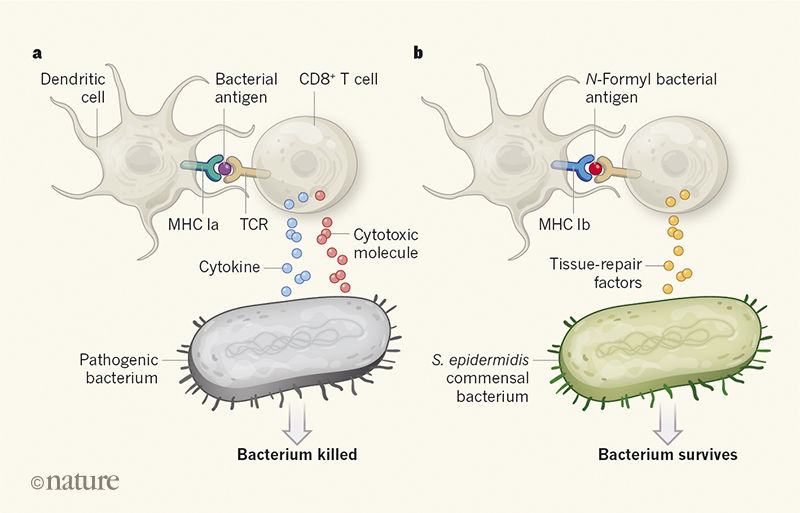
Rycina 1 | Reakcja limfocytów T zabójców na infekcję bakteryjną. a, Komórka immunologiczna zwana limfocytem T CD8+ (limfocyt T) może pomóc w kontroli infekcji patogenną bakterią. Receptor limfocytów T (TCR) rozpoznaje infekcję, gdy peptyd bakteryjny zwany antygenem jest prezentowany na komórkach dendrytycznych układu odpornościowego za pośrednictwem białka MHC klasy Ia. Następnie zostaje wyzwolona konwencjonalna odpowiedź limfocytów T, a uwalnianie cytokin i cząsteczek cytotoksycznych uruchamia stan zapalny i destrukcję bakterii. b, Linehan i wsp.1 opisują analizę reakcji limfocytów T zabójców na Staphylococcus epidermidis przy użyciu modeli komórek mysich i ludzkich. Ten rodzaj bakterii, nazywany komensalem, może stać się długoterminowym, niepatogenicznym organizmem bytującym w ciele. Limfocyty T zabójcy rozpoznają S. epidermidis, gdy cząsteczka MHC klasy Ib prezentuje antygen zawierający modyfikację N-formylową reszty aminokwasowej. Limfocyt T wyraża geny związane z naprawą tkanki, a bakteria jest w stanie przetrwać tą „niekonwencjonalną” reakcję. Tego typu reakcje immunologiczne prawdopodobnie nie podlegają starannemu podziałowi na te kategorie, a konwencjonalne odpowiedzi limfocytów T mogą w niektórych przypadkach wspomagać naprawę tkanek, z kolei niekonwencjonalne reakcje limfocytów T mogą wspomagać obronę gospodarza przed patogenami.
Wykorzystując mysi model gojenia ran skóry in vivo w związku z kolonizacją S. epidermidis, autorzy wykazali, że oznaczenie ekspresji genów naprawy tkanek w wykazujących odpowiedź limfocytach T wiąże się z pobudzaniem reakcji gojenia. W ten sposób identyfikacja bakterii rezydujących na skórzeÂÂ przez układ immunologiczny może indukować formę odporności, która nie działa bezpośrednio destrukcyjnie na bakterię, a zamiast tego wspomaga naprawę tkanek.
Obserwacje autorów przyczyniają się do coraz lepszej świadomości zróżnicowanych funkcji innych niekonwencjonalnych limfocytów T, które znajdują się w miejscach występowania barier i które mogą rozpoznawać zachowane ewolucyjnie cząsteczki drobnoustrojów. Wśród tych komórek znajdują się na przykład konserwatywne limfocyty T związane z błoną śluzową, które występują obficie u ludzi i są indukowane przez komensale oraz dzielą kilka cech5 populacji limfocytów T badanej przez Linehana i jego współpracowników — takich jak produkcja sygnalizującej cząsteczki, interleukiny-17A. Te i inne populacje limfocytów T u ludzi i myszy, takie jak niezmienne naturalne limfocyty T zabójcy i limfocyty T reagujące na grzyby kodowane przez linię germinalną, działają również w odpowiedzi na rozpoznawanie peptydów bakteryjnych mediowanych przez MHC klasy Ib Dotychczas nie zidentyfikowano ludzkiego odpowiednika mysiego H2-M3. Możliwe jest, że w przypadku znalezienia takiego odpowiednika ludzka populacja limfocytów T może spełniać podobną rolę jak komórki CD8+ T obserwowane przez Linehana i jego współpracowników.
Jak zauważają autorzy, wiele codziennych interakcji pomiędzy komórkami układu odpornościowego a mikrobami zachodzi prawdopodobnie z komensalami w skórze, jelitach i drogach oddechowych. Dlatego też korzystna może być reakcja immunologiczna utrzymująca status quo, a nie napędzająca eliminację bakterii, której zwykle towarzyszy stan zapalny i uszkodzenie tkanek. Jednak czy taka reakcja naprawdę powinna być uznawana za niekonwencjonalną? Chociaż najpierw zidentyfikowano rolę klasycznych cząsteczek MHC i reagujących komórek immunologicznych, nieklasyczne białka MHC i białka typu MHC są ewolucyjnie starsze niż cząsteczki MHC klasy Ia. Linehan wraz z kolegami ujawnia bezpośredni związek między rolą cząsteczek MHC klasy Ib a homeostazą tkankową. Tym samym funkcje te mogły ewoluować równolegle i reprezentować szeroko "konwencjonalne" funkcje układu odpornościowego, przy czym z czasem ewoluowały dodatkowe specjalizacje układu odpornościowego.
Autorzy badania wskazują na potencjalnie szeroki, długofalowy wpływ drobnoustrojów bytujących na układ odpornościowy. Jeżeli przyszłe badania mechanicznie połączą poszczególne mikroorganizmy z określonymi rodzajami reakcji immunologicznej, możliwe będzie nie tylko zrozumienie roli niektórych obficie występujących i stosunkowo niezbadanych populacji komórek immunologicznych, ale także określenie, w jaki sposób mikroorganizmy będące rezydentami wpływają na zdrowie i choroby, w sposób, który może prowadzić do nowych metod leczenia.
Źródło: www.nature.com/articles/d41586-018-03510-z
http://laboratoria.net/naturecom/28316.html