- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Badania kliniczne, cz.III. Uczestnicy badań klinicznch i etyka badań
Z kolei, podstawe zasady rejestracji badanych produktów generycznych zostały ustalone w1984 roku Stanach Zjednoczonych. W Europie podstawy reguł badan równoważności biologicznej w celu rejestracji produktów generycznych zostały zatwierdzone w 1991, po czym uzupełni ono je w 2001. Zazwyczaj mija kilkanaście lat od powstania koncepc ji oryginalnego produktu leczniczego do jego wejścia na rynek (rejestracji) [6].
Uczestnicy badania klinicznego oraz podmioty zaangażowane
W cały proces przeprowadzenia badania klinicznego zaangażowani są:
1) Sponsorzy
- osoba fizyczna, osoba prawna albo jednostka organizacyjna nieposiadająca osobowości prawnej,
- odpowiedzialna za podjęcie, prowadzenie oraz finansowanie danego badania klinicznego,
- osoba, która ma siedzibę na terytorium jednego z państw członkowskich Unii Europejskiej lub państw członkowskich Europejskiego Porozumienia o Wolnym Handlu (EFTA).
W przypadku, gdy sponsor badania klinicznego nie ma siedziby na terytorium jednego z państw Europejskiego Obszaru Gospodarczego, może działać wyłącznie przez swojego prawnego przedstawiciela posiadającego siedzibę na tym terytorium.
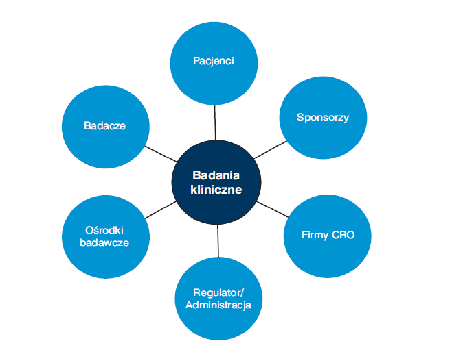
Sponsor może przekazać niektóre (lub wszystkie) swoje obowiązki i funkcje CRO, jednak ostateczna odpowiedzialność za jakość i zgodność danych zawsze pozostaje po stronie sponsora. Przekazanie obowiązków musi odbyć się drogą pisemną. CRO zobowiązana jest wprowadzić system zapewnienia jakości i jej kontroli w trakcie trwania badania. Aktualnie, w Polsce obecnych jest ok. 50 firm typu CRO: są to zarówno oddziały globalnych firm, jak i niewielkie (o lokalnym zasięgu).
4) Badacze/Lekarze: mają bezpośredni kontakt z uczestnikami badania klinicznego (pacjentami). Badacze pracują albu indywidualnie albo z zespołem asystentów ( w zależności od zakresu proadzonych badań). Za wybór badacza oraz ośrodka badawczego odpowiada Sponsor.
5) Pacjenci: trafiają do badania klinicznego w wyniku dobrowolnego zgłoszenia. Ponadto, pacjent ma prowa do odmowy udziału w badaniu na każdym jego etapie, nie ponosząc z tego żadnych konsekwencji. Pacjenci poddają się badaniu zarówno w warunkach ambulatoryjnych jak i szpitalnych.
6) Regulatorzy rynku/Administracja: instytucje nadzorujące i komisje bioetyczne opiniuja pozytywne lub negatywne wyniki badań klinicznych, a także zatwierdzaja bądź odrzucają wniosek rozpoczęcia badania klinicznego. Rolą administracji jest też zapewnienie, że w trakcie trwania badania pzrestrzegane jest prawo oraz wymagania Międzynarodowej Konferencji ds. Harmonizacji (ICH) i Dobrej Praktyki Klinicznej (GCP)[7], [8].
Etyka w badaniach klinicznych
W 1964 roku w Helsinkach podczas konferencji Światowego Stowarzyszenia Lekarskiego (World Medical Association –WMA) sformułowano tzw. Deklarację Helsińską, która określaął etyczne zasady prowadzenia badań medycznych z udziałem ludzi [3], [5].
Istotne treści Deklaracji Helsińskiej pozostają bez zmian od czasu jej sformułowania i dalszego aktualizowania i rozszerzania podczas kolejnych walnych zgromadzeń WMA w różnych częściach świata. Ogólnie najważneijsze części Deklaracji można ująć w 7 tezach:
„ 1. Każde badanie z udziałem ludzi powinno mieć podstawy naukowe i tam, gdzie to właściwe, powinno być poprzedzone badaniami laboratoryjnymi i badaniami z udziałem zwierzat.
2. Powinien istnieć protokół badania.
3. Protokół badania powinien być zatwierdzony przez niezależną (od badacza
i sponsora) Komisję Bioetyczną.
5. Uczestnik badania powinien wyrazić zgodę na piśmie.
6. Badacz powinien posiadać odpowiednie kwalifikacje.
7 Badacz (i sponsor) jest odpowiedzialny za bezpieczeństwo pacjenta w badaniu” [1], [2].
Kolejnym kamieniem milowym w ochronie pacjenta uczestniczącego w badaniach klinicznych, było ustalenie Zasad Dobrej Praktyki Klinicznej (GCP). Zasady te zostały następnie uzupełnione przez Międzynarodową Konferencję ds. Harmonizacji (ICH). I tak od 1996 roku normy ICH GCP są przestrzegane na całym świecie i stanowią podstawę wszystkich zasad etycznych dotyczących prowadzenia badań klinicznych, które to w szczególny sposób mają za zadanie chronić człowieka poddanego badaniom eksperymentalnym [1], [5].
Autor: Lidia Koperwas
Literatura:
[1]. Dr Brusiło J., OFMConv., 2007. Badania kliniczne (eksperymenty medyczne) w kontekście wartości personalistycznych. Referat przedstawiony w ramach konferencji Chrzescijanskiego Forum Pracowników Nauki “Nauka-Etyka-Wiara” w Rogowie, 18-21 X 2007r.
[2]. Walter M., Miedzynarodowe uregulowania badan klinicznych – Deklaracja Helsinska, Zasady Dobrej Praktyki Badan Klinicznych (GCP), Miedzynarodowa Konferencja do spraw Harmonizacji (ICH) (w:) Badania kliniczne. Organizacja, nadzór i monitorowanie, ten_e (red.), Warszawa 2004, s. 49–50.
[3]. http://www.oil.org.pl/xml/oil/oil68/tematy/deklaracja_helsinska
[4].http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Efficacy/E6_R1/Step4/E6_R1Guideline.pdf
[5]. Brody B. A., The Ethics of Biomedical Research. An International Perspective, Oxford 1998, s. 213.
[6]. http://www.mtz-clinical.pl/downloads/projektowanie_badan_biorownowaznosci.pdf
[7].http://infarma.pl/fileadmin/badania_kliniczne_raport/Badania%20kliniczne%20w%20Polsce%202010.pdf
[8].http://www.badaniaklinicznewpolsce.pl/najwazniejsze-informacje-dla-uczestnika-badan/wazne-dla-uczestnikow-badan-klinicznych/bezpieczenstwo-i-prawa-uczestnika-badania-klinicznego/
Tagi: badanie kliniczne, sponsor, badacz, pacjent, SOP, CRO, CRA, ICH, GCP, komisja bioetyczna, etyka badań klinicznych, Deklaracja Helsińska, Kodeks Norymberski, WMA
wstecz Podziel się ze znajomymi









Recenzje