- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Dzień dobry, mam na imię Atom.
Historia atomu
Już starożytni filozofowie greccy zadawali pytania o to z czego zbudowana jest otaczająca nas materia. Jedna z teorii, którą głosił Demokryt z Abdery, mówiła o istnieniu niepodzielnego składnika atomos. Nie była to wszakże teoria naukowa, ale rozprawą filozoficzną na temat budowy materii.
Zwolennikami teorii atomistycznej był m in. żyjący w latach 1627 - 1691 Robert Boyle oraz słynny fizyk, matematyk, astronom Izaak Newton. Wraz z rozwojem nauki, hipoteza istnienia atomu zaczynała być coraz bardziej prawdopodobna, chodź we wczesnych latach dwudziestego wieku wielu naukowców wciąż nie wierzyło w istnienie atomów.
Atom, istnieje na prawdę.
Francuski naukowiec Antoine-Laurent Lavoisier pracując nad prawem zachowania masy w chemii opisał, w swojej pracy z 1789 roku Traité Élementaire de Chimie (Elementy Chemii), pierwiastki jako niepodzielne elementy materii [1]. Cztery lata później John Dalton w pracy A New System of Chemical Philosophy głosił teorię atomizmu. Zakładał on, że materia zbudowana jest z atomów, a każdy pierwiastek składa się z atomów tego samego rodzaju (Rysunek 1).

Rysunek 1: Oznaczone przez Johna Daltona pierwiastki, zdjęcie z traktatów A New System of Chemical Philosophy.
Pierwszy model struktury atomu zaproponował angielski fizyk Joseph John Thompson w swojej pracy z 1904 roku. Badając promieniowanie katodowe odkrył on istnienie elektronu. Ostatecznie odkrycie to zaprzeczyło teorii niepodzielności atomu [2]. Model Thomhsona zakładał istnienie ujemnie naładowanych elektronów, które poruszały się w jednorodnej dodatnio naładowanej kuli, stąd nazwano go ciastkiem z rodzynkami (Rysunek 2 a)). Model ciastka z rodzynkami został obalony, gdy w 1909 Ernest Marsden i Hans Geiger pod kierunkiem Ernest Rutherforda przeprowadzili słynny eksperyment, bombardowali oni złotą folię cząstkami alfa [3]. Model Thompsona nie wyjaśniał dobrze, dlaczego część cząstek alfa przelatuje inne zaś rozpraszają się na złotej folii. W roku 1911 Ernest Rutherford zaproponował nowy model atomu. Zakładał on, że większość masy skupiona jest w dodatnim jądrze, a ujemnie naładowane elektrony krążą wokół niego. Były to założenia zbliżone współczesnemu modelowi. Niedługo później, bo w roku 1913, Niehls Bohr opublikował pracę, w której zaproponował model budowy atomu wodoru [4]. Model ten oparł się na dwóch postulatach. Po pierwsze: moment pędu elektronu przyjmuje tylko pewne wartości (nħ, ħ jest tzw. zmodyfikowaną stałą Plancka, natomiast n jest dowolną liczbą naturalną). Po drugie: elektron może przejść z jednej orbity na inną dozwoloną (Rysunek 2 b)) czemu towarzyszy wypromieniowanie (bądź zaabsorbowanie) fotonu (porcji światła) o energii równej różnicy energii tych poziomów.
a)

b)
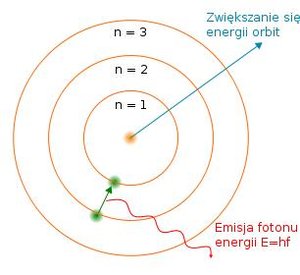
Rysunek 2: a) Model atomu Thompsona (ciastko z rodzynkami), ujemnie naładowane elektrony znajdują się wewnątrz jednorodnej dodatnio naładowanej kuli. b) Model atomu wodoru Bohra, w centralnej części znajduje się jądro (proton) wokół którego krąży elektron.
Elektron porusza się po orbitach o ściśle określonej energii (Eelektronu = nħ). Przejściu elektronu z jednej orbity na drugą towarzyszy wypromieniowanie bądź pochłonięcie energii w postaci fotonu (porcji światła) o energii równej różnicy energii tych orbit (Ewypromieniowane/pochłoniete = hf, gdzie h jest wielkością stałą w fizyce stała Plancka, a f częstotliwością wypromieniowanego światła) [5].}

Rysunek 3: Drabinka energetyczna. Elektron może znajdować się tylko w ściśle określonym stanie, który reprezentują szczebelki drabinki. Przyjmuje on więc jedynie określone wartości energii.
Atom dziś.
Model atomu wodoru zaproponowany przez Nielsa Bohra zakładał, że wokół protonu (jądra) po kołowych orbitach krąży elektron (Rysunek 2 b)). Energia jaką może przyjmować elektron jest ściśle określona. Doskonale obrazuje to zamieszczona na Rysunku 3 drabinka. Każdy ze szczebelków drabinki reprezentuje jakąś wartość energii, a sam elektron może wędrować w górę i w dół drabinki ale tylko po szczebelkach. Nie może posiadać innej energii.
Zgodnie z założeniami mechaniki klasycznej elektron poruszający się po kołowej orbicie powinien wypromieniowywać energię, a w konsekwencji spaść na jądro. Tak się jednak nie dzieje, a wytłumaczenie pojawiło się wraz z odkryciem mechaniki kwantowej.
Jądro atomowe wodoru składa się z jednego dodatnio naładowanego protonu. Atomy bardziej złożonych pierwiastków składają się nie tylko z dodatnich protonów ale i z elektrycznie obojętnych neutronów. Nukleony, bo tak nazwano cząstki budujące jądra atomowe, są dużo cięższe od elektronów, a ich masy są do siebie zbliżone. Praktycznie cała masa atomu skupiona jest więc w jego centrum. Rozmiary jądra atomowego są rzędu 10^{-15}, natomiast rozmiar całego atomu (wraz z krążącymi wokół jądra elektronami) to rząd wielkości 10^{-10} m [6]. Gdyby więc jądro atomowe miało promień 1 metra, to jego pierwszy elektron krążyłby po orbicie o promieniu około 100 km.
Dzięki mechanice kwantowej poznaliśmy właściwości atomów, które pozwoliły na dalsze odkrycia. Skonstruowano lasery, które emitują światło o szczególnych własnościach. Powstały tomografy, których działanie opiera się na własnościach fizycznych jądra atomowego.
Dziś o atomach wiemy bardzo dużo, znamy ich właściwości. Potrafimy nawet złapać pojedynczy atomy. Wiemy, że większość masy atomu skupiona jest w jądrze, a pomiędzy jądrem a krążącymi wokół niego elektronami znajduje się pusta przestrzeń. Atomy łączą się, tworząc trwałe cząsteczki i ciała stałe. Tworzą one nasz realny świat i pozostały niezmienione od czasu jego powstania [6].
Autor: Ada Umińska
Literatura:
[1] Department of Chemistry Le Moyne College. Elements and atoms: Chapter
3, lavoisier’s elements of chemisty on-line.
[2] Biografia J. J. Thompsona Fundacja Noblowska.
[3] Biografia E. Rutherforda Fundacja Noblowska.
[4] Biografia N. Bohra Fundacja Noblowska.
[5] Wikipedia.
[6] Jearl Walker David Halliday, Robert Resnick. Podstawy Fizyki część 5. Wydawnictwo
Naukowe PWN, 2005.
Jak podobał Wam się artykuł? Oceńcie sami! Zachęcamy do wypełnienia naszej sondy!
ARTYKUŁ DO POBRANIA: Laboratoria.net - Dzień dobry, mam na imię Atom.
Tagi: atom, historia atomu, Robert Boyle, Izaak Newton, John Thompson, elekton, elektrony, jądro atomowe, lab, laboratorium, laboratoria
wstecz Podziel się ze znajomymi









Recenzje