- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Miareczkowanie - praktyczne wykorzystanie i znaczenie metody
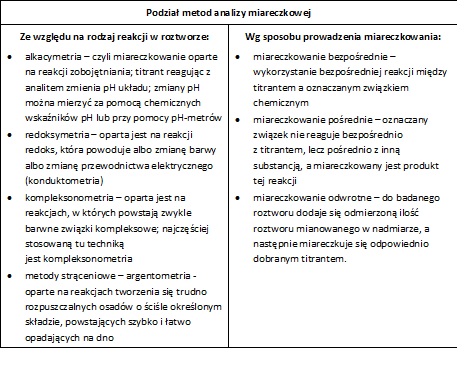
Analiza miareczkowa polega na tym, iż niewielkimi porcjami, czyli "miareczkami" wprowadza się do roztworu badanego równoważną chemicznie ilość odczynnika w postaci roztworu mianowanego, czyli roztworu o dokładnie znanym stężeniu. W celu rozpoznania momentu równowagowego do badanej próbki wprowadza się wskaźnik (indykator), który poprzez zmianę barwy pozwoli na detekcję tego momentu. Moment, w którym wskaźnik zmienia barwę, nazywa się punktem końcowym miareczkowania. Ilość oznaczanej substancji oblicza się na podstawie dokładnie zmierzonej objętości zużytego roztworu mianowanego. Istnieją także inne metody oznaczania punktu końcowego [1, 2].
- przebiegające stechiometrycznie (ilościowo)
- przebiegające szybko
- których punkt równoważnikowy można dokładnie wyznaczyć
- w których biorą udział związki chemiczne tworzące roztwory trwałe w warunkach miareczkowania.
Rysunek 1. Sprzęt do analizy miareczkowej: 1 – statyw; 2 – biureta; 3 – roztwór mianowany; 4- elenmajerka; 5 – roztwór badany.
- Bardzo dokładnie umyć i osuszyć biuretę. Czysta woda spływała równomiernie po ściankach, nie pozostawiając kropel. Mikrokrople występujące na ściankach biurety są najczęstszą przyczyną błędów pomiarowych.
- Kran biurety również powinien być czysty i suchy. Dopiero tak przygotowany kran pokrywamy pokryć cienką warstwą wazeliny. Należy pamiętać, iż poprawnie nasmarowany kran powinien być przezroczysty, a nie matowy!
- Każdorazowo przed miareczkowanie przygotowana biuretę (1) przemywa się 2-3 razy niewielkimi ilościami roztworu mianowanego. Zapobiega to rozcieńczaniu roztworu mianowanego wodą, pozostającą zwykle na ściankach i w końcówce biurety.
- Biureta poprawnie umieszczona w statywie jest w położeniu dokładnie pionowym.
- Początkowo napełnić biuretę nieco powyżej kreski zerowej roztworem mianowanym. Roztwór mianowany można wlewać przez lejek, pamiętając jednak o wyjęciu lejka zaraz po nalaniu roztworu, aby w czasie miareczkowania nie spływały z niego do biurety krople roztworu.
- Należy całkowicie usunąć powietrze z końcówki biurety, zastępując je roztworem. Pozostawienie w rurce powietrza to błąd nawet kilku dziesiątych cm3 przy odczycie objętości.
- Po wprowadzeniu roztworu mianowanego oraz odpowietrzenia biurety należy doprowadzić poziom roztworu w biurecie dokładnie do kreski zerowej, wylewając nadmiar roztworu do podstawionego naczynia. Nie dopełniać biurety w trakcie miareczkowania
- Kroplę pozostałą na biurecie usuwa się poprzez dotknięcie końcem biurety do naczynia. Nigdy w tym celu nie używamy bibuły.
- Każde miareczkowanie należy zaczynać od poziomu zerowego, co zmniejsza niedokładność odczytu związanego z podziałką.
- Roztwór z biurety należy podawać małymi porcjami, nie śpiesząc się. Najczęstszym błędem miareczkowania jest tzw. przemiareczkowanie, w tym przypadku pewna ilość cieczy pozostanie także na ściankach biurety, skutkiem czego objętość zużytego roztworu będzie pozornie większa. Roztwór mianowany powinien wypływać z biurety kroplami.
- Przy przemiareczkowaniu można zastosować poprawkę, w tym celu należy określić objętość jednej kropli (inna dla każdej biurety!): wypuścić z biurety 100 kropel roztworu i na podstawie zmiany położenia menisku określić ich objętość sumaryczną. Następnie podzielić otrzymaną objętość przez 100 i otrzymuje się objętość jednej kropli.
- Do obliczeń stosujemy rzeczywistą (naważoną) masę substancji.
Znaczenie analizy miareczkowej [1, 2, 3]
Metodę tę stosujemy do kilku podstawowych doświadczeń:
a. Indykator kwasowo-zasadowy
b. Przygotowania roztworów buforowych z wykorzystanie elektrody pH-metrycznej
c. Badań hydrolizy soli
d. Wpływ temperatury na stopień hydrolizy
e. Efekt wspólnego jonu
f. Efekt solny
g. Określania amfoteryczności
h. Miareczkowania alkacymetrycznego
Autor: Karolina Wójciuk
[1] Iwona Żak, Anna Balcerzyk: Analiza miareczkowa. W: Iwona Żak (red.): Chemia medyczna. Katowice: Śląska Akademia Medyczna, 2001
[2] Tadeusz Lipiec, Zdzisław S. Szmal: Chemia Analityczna z elementami analizy instrumentalnej. Państwowy Zakład Wydawnictw Lekarskich, 1980
[3] http://pl.mt.com/pl/pl/home/supportive_content/know_how/Dummy_Basics_of_Titration_Handbook.html
Tagi: miareczkowanie, poprawne miareczkowanie, analiza miareczkowa, lab, laboratorium, biotechnologia
wstecz Podziel się ze znajomymi









Recenzje