- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Niezwykłe właściwości zwykłych polisacharydów - glikozaminoglikany: właściwości i zastosowanie w medycynie, cz. II
Ilościowe oznaczanie kwasów uronowych metodą boranową (T.Bitter) [5].
W środowisku stężonego kwasu siarkowego zachodzi reakcja kondensacji odpowiednich bezwodników kwasów uronowych z organicznym związkiem chemicznym- karbazolem. W reakcji tej jony boranowe pełnią funkcje katalityczne, a dodatkowo wzmagają czułość reakcji i znacznie zwiększają trwałość powstałych produktów kondensacji [Kłyszejko s. 288-289), [5].
Wykonanie:
Do probówek umieszczonych w wodzie z lodem należy wprowadzić po 5 ml roztworu kwasu siarkowego – boran (tj. stężony roztwór H2SO4 cz.d.a. zawierający 0,025 M czteroboran sodu), po czym nawarstwić (nie dotykając ścianek) 1 ml próby badanej , a w przypadku próby kontrolnej(wzorcowy roztwór kwasu galakuronowego o stężeniu 100 ug/ml) 1 ml wody [5].
Następnie, całość dobrze wymieszać używając w tym celu cienką bagietkę szklaną (nie wyjmując probówek z łaźni wodnej). Po wymieszaniu, probówki przenieść do wrzącej łaźni wodnej na 15 minut, zaś po upływie czasu inkubacji probówki ochłodzić, dodając do każdej 0,2 ml etanolowego roztworu karbazolu (tj. 0,125% roztwór karbazolu w w etanolu bezwodnym) , całość dokładnie wymieszać. Próbki ponownie wstawić do wrzącej łaźni wodnej na 10 minut. Po inkubacji ostrożnie schłodzić i oznaczyć wartość absorbancji przy λ=530 nm wobec próby kontrolnej. Powstała w probówkach barwa jest trwała przez ok 16 godzin [5], [3].
W sposób analogiczny należy wykonać oznaczenie dla wzorcowych roztworów kwasu galakturonowego (10, 20, 30, 50 ug/ml), a z uzyskanych absorbancji sporządzić wykres krzywej kalibracyjnej [5], [3].
Ilościowe oznaczanie siarczanów chondroityny metodą zmętnieniową [4].
Podstwą tej metody jest tworzenie słabo rozpuszczalnych kompleksów między polianionami a czwartorzędową zasadą, np. amonobromkiem cetylopirydyny. Powstałe w reakcji zmętnienie jest w pewnych granicach proporcjonalne do stężenia polianionu [4].
Wykonanie:
Do 1 ml próbki , która zawiera od 50 do 200 ug siarczanów chondroityny dodać 1 ml buforu octanowego (tj. 0,2 M bufor octanowy o pH=6.0). Następnie, do próbki dodać 2 ml roztworu CPABr (tj. 2,5% roztwór CPABr w 0,5 M NaOH). Próbkę dokładnie wymieszać , po czym wstawić do cieplarki o temperaturze 37C na 10 minut. Po upływie czasu inkubcji należy zmierzyć absorbancję przy λ= 420 nm. Zawartość siarczanów chondroityny w próbce wyliczyć na podstawie stężenia roztworu wzorcowego o stężeniu 100 ug/ml [4], [3].
Izolowanie kompleksu białkowego kwasu hialuronowego z ciałka szklistego oka (Meyer) [1], [3].
Natywny kwas hialuronowy występuje w formie rozpuszczalnej , np. w ciałku szklistym oka lub w płynie stawowym . Kwas ten może występować także w formie żelu , gdzie w takiej formie spotyka się go np. w pępowinie – jest to tzw. galareta Whortona. Co ciekawe nie wykryto różnicy w składzie kwasy hialuronowego w zależności od formy jego występowania, zaś właściwości fizykochemiczne tego kwasu (a głównie jego lepkość) zależą od metody jego izolowania [1].
I tak, kompleksy białkowe kwasu hialuronowego z ciałka szklistego rozcieńcza się w wodzie, a następnie zakwasza , co z kolei powoduje wypadanie tych kompelksów z roztworu. Wielkocząsteczkowy kwas hialuronowy wytrąca się z roztworu w postaci długich wkłókien określanych jako zlepki mucynowe, zaś małocząsteczkowy kwas jako drobne kłaczki. Uzyskane preparaty najpierw się odbiałcza, po czym wytrąca się je w postaci włókienek za pomocą etanolu [1]
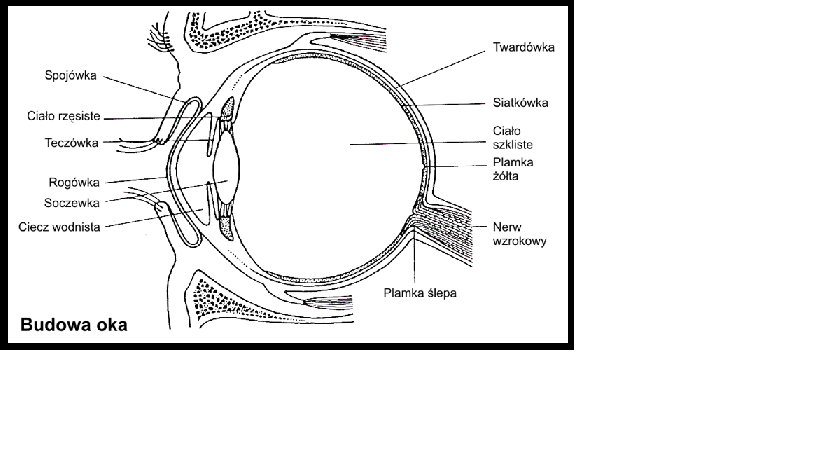
Wykonanie:
Jako materiał wyjściowy do badań stosuje się gałki oczne bydła (dokładnie wołu), które pobiera się natychmiast po uboju bydła do termosu z kruszonym lodem. W celu przystąpienia do izolacji, w początkowym etapie metody wypreparowuje się ok. 50 g świeżego ciałka szklistego z oka. Następnie, próbkę rozcieńcza się 2 –objętościami wody destylowanej i homogenizuje się w homogenizatorze nożowym , chłodząc go w wodzie z lodem przez ok. 3 do 5 minut. W ten sposób otrzymuje się opalizujący płyn, który należy zakwasić za pomocą lodowatego kwasu octowego (CH3COOH) do pH=4, po czym odstawić do lodówki na ok. 12 godzin, w czasie których formuje sie osad kompleksów białkowych kwasu hialuronowego. Po inkubacji, osad należy odwirować i rozpuścić w 25 ml buforu octanowego (tj. 5% (CH3COO)2 Ca w 3% roztworze CH3COOH (pH=6.0), dalej dodać 2 objętości etanolu (98%) i ponowni e odstawić do lodówki na 12 godzin. Utworzony w ten sposób strąt odwirować, rozpuścić w buforze octanowym i zadać 2 objętościami etanolu. Osad oczyszczonych częściowo kompleksów kwasu hialuronowego z białkiem rozpuścić ponownie w 50 ml buforu octanowego [1], [3].
W celu odbiałczenia należy dodać do roztworu 25 ml chloroformu i kilka kropli alkoholu amylowego. Następnie, całość przenieść do rozdzielacza szklanego i wytrząsać przez ok. 20 minut, powstałą fazę wodną odwirować przy 10 000xg, przez 10 minut. Otrzymany po wirowaniu klarowny supernatant przenieść do zlewki i zalać 2 objętościami etanolu, w celu wytrącenia kwasu hialuronowego – czynność tę powtarzać 2- 3 razy. Po ostatnim wirowaniu osad kwasu hialuronowego przemyć za pomocą etanolu, następnie mieszaniną etanolu i eteru (w stosunku 1:1), a na koniec wysuszyć eterem. Całość przenieść do eksykatora próżniowego. Otrzymany preparat może być wykorzystywany jako substrat do oznaczania aktywności hialuronidazy. [1], [3].
Hialuronian
Hialuronian (HA), występujący in vivo jako polianion kwasu hialuronowego, jest niesiarczanowanym, ujemnie naładowanym biopolimerem. Składa się z powtarzających się disacharydowych jednostek, które zawierająv kwas D-glukuronowy i N-acetylo-D-glukozoaminę. Ponadto, gialuronian należy do rodziny glikozaminoglikanów (GAG) [2].
Pomimo nieskomplikowanej struktury, hialuronian posiada szeroki zakres biologicznych funkcji, a dodatkowo ogromna liczba białek wiążących hialuronian (HA), często nazywanych hialadherynami, o zróżnicowanej tkankowej ekspresji i komórkowym umiejscowieniu, swoistości, powinowactwie wiązania, jak i podlegających zróżnicowanym mechanizmom regulacyjnym, przez co determinują szeroki zakres oddziaływań hialuronianu w ustroju. Cząsteczki kwasu hialuronowego występują zarówno we wszystkich tkankach i płynach ustrojowych organizmu kręgowców, jak i w otoczkach ścian komórkowych bakterii wielu patogennych szczepów, w tym z rodzaju Pasteurella czy Streptococcus [2].
W organizmie kwas hialuronowy pełni wiele ważnych funkcji, jednak jego główne zadanie polega na utrzymywaniu równowagi homeostatycznej, nie wykazując zdolności aktywowania procesów immunologicznych. Najnowsze badania donoszą, iż oligomery hialuronianu maja zdolność stymulowania procesów komórkowej migracji, proliferacji i dojrzewania, wykazując również tzw. działanie proangiogenne. Ponadto, przejawia także zdolność indukowania w komórkach śródbłonkowych, nabłonkowych, dendrytycznych, w fibroblastach oraz makrofagach, ekspresji genów zapalnych, czego następstwem jest włączenie ekspresji chemokin (np. MIP-1α, MIP-1β), a dalej ekspresję cytokin (np. IL-12 czy TNF-α) [2].
Metoda izolacji siarczanu dermatanu oraz siarczanów chondroityny (K. Meyer) [1], [3].
Jak już wspomniano, wszystkie GAG występują w tkankach w postaci związanej z białkami. Tak więc, aby wyizolować mieszaninę GAG, należy je najpierw uwolnić od białek tkankowych, co odbywa się najczęściej poprzez proteolizę tkanki. Następnie, otrzymaną mieszaninę GAG można rozfrakcjonować wykorzystując w tym celu różną rozpuszczalność ich soli wapniowych w roztworach etanolu [1].
Siarczan dermatanu należy do najtrudniej rozpuszczalnych związków, wypada on z roztworu przy 18% stężeniu etanolu, zaś chondroityno-4-siarczan przy stężeniu 30%-40%. Chondroityno-6-siarczan i siarczan keratanu wypada z roztworu przy 50% stężeniu etanolu [1], [3].
Wykonanie:
Jako materiał do preparatyki GAG używa się m.in. twardówki gałki ocznej, W tym celu wykorzystuje się gałki bydlęce(wołu)- podobnie jak podczas izolacji kwasu hialuronowego [1], [3].
Po dokładnym przemyciu rozdrobnionej twardówki, całą otrzymaną masę należy zemleć w maszynce do mięsa i odwodnić etanolem. 50 g uzyskanej suchej masy poddać trawieniu za pomocą enzymu papainy (papaina oczyszczona o aktywności 1,5-3,5 U/mg) w buforze octanowym o pH-6.0 (tj. 5% (CH3COO)2 Ca w 3% roztworze CH3COOH (pH=6.0) [1].
Należy przygotować mieszaninę trawiącą w następujący sposób: do 100 ml 0,1M roztworu CH3COONa dodać 1 g papainy, całość dokładnie wymieszać. Do zawiesiny wprowadzić aktywatory enzymu tj. 100 mg wersenianu sodu (krystaliczny) i 60 mg chlorowodorku cysteiny(lub 20 mg ditiotreitolu). Na 1 g suchej twardówki dodać 5 ml mieszaniny trawiącej oraz kilka kropli toluenu, mieszaninę wstawić do ceplarki do 50 st. C na 24 godziny. Po inkubacji, całość przesączyć i zmierzyć otzrymaną objętość. Następnie, dodać CH3COONa do końcowego stężenia 5% i lodowatego CH3COOH do stężenia 3%. Całość dokładnie wymieszać i ponownie zmierzyć objętość. Następnie, wprowadzić 1,5 objętości etanolu, wymieszać i wstawić do lodówki na 12 godzin. Po inkubacji, próbkę odwirować a otzrymany osad rozpuścić w 50 ml buforu węglanowego(0,1 M bufor węglanowy o pH=8.6 ). Następnie, dodać 100 mg krystalicznej trypsyny, kilka kropli toluenu i ponownie wstaawić do cieplarki na 18 godzin. Otrzymany hydrolizat zobojętnić za pomocą lodowatego kwasu octowego do pH=7.0, zmierzyć objętość całości, po czym dodać (CH3COO)2Ca (w stanie stałym ) do 5%, a CH3OOH do stężenia 3%. Powstały ewentualny strąt odwirować, a następnie odrzucić. Do całości (po wirowaniu) wprowadzić 1,5 objętości etanolu i pozostawić w chłodnia 12 godzin [1].
Wydzielony po odstaniu osad należy odwirować, po czym rozpuścić w 100 ml buforu octanowego. Wlać 50 ml chloroformu, kilka kropli alkoholu amylowego, całość wytrząsać w rozdzielaczu przez 20 minut w celu odbiałczenia próbki. PO tym czasie, próbkę odwirować, zebrać supernatant, zmierzyć jego objętość, i dodać do niego 1,5 objętości etanolu. Odbiałczanie należy powtórzyć ok. 2-3 razy (w zależności od ilości białek balastowych). Po wprowadzeniu do próbki ostatniej porcji etanolu, całość wstawić do lodówki na 12 godzi [3].
Powstały po odstaniu 12 h osad rozpuścić w 75 ml buforu octanowego, dodać kroplami (ciągle mieszając) etanolu do stężenia 20%. W ten sposób wytrąca się siarczan dermatanu. Po godzinie próbkę odwirować, po czym przemyć kilka razy etanolem, następnie mieszaniną etanol-eter (w stosunku 1:1), a na koniec eterem. Osad wysuszyć w eksykatorze próżniowym. Do pozostałego po wirowaniu supernatantu dodać (po zmierzeniu jego objętości) dodać etanolu do końcowego stężenia 35%. W ten sposób wypada z roztworu osad, który w większości złożony jest z chondroityno-4-siarczanu. Odwirować i wysuszyć (jak wyżej) [1], [3].
Z kolei, do końcowego supernatantu dodać kroplami etanol do stężenia 50%, co wytrąca chondroityno-6-siarczan oraz siarczan keratanu.
Otzrymane w opisany sposób wszystkie frakcje GAG, oprócz oprócz głównego składnika zawierają także małe ilości zbliżonych polisacharydów. Frakcje te mogą być wykorzystane do uzyskania wysoko oczyszczonych glikozaminoglikuronoglikanów [1], [3].
Autor: Lidia Koperwas
Literatura:
[1]. Meyer K., Palmer J.W., 1934. J. Biol. Chem. 107:629-632 wg Hyaluronic acid [in] Brimacombe J.S., Webber J.M.: Mucopolysaccharides. Elsevier Publ. Co., Amsterdam 1964, p.43-63
[2]. Olczyk P., Komosińska-Vassev K, Winsz-Szczotka K.,Kuźnik-Trocha K, Olczyk K., 2008. Hyaluronan: Structure, metabolism, functions, and role in wound healing. Postepy Hig Med Dosw. (online), 2008; 62: 651-659
[3]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 288-291.
[4]. Di Ferrante N., 1956. Turbidimetric measurment of acid mucopolysaccharides and hialuronidase activity. J. Biol. Chem., 220: 303-305.
[5]. Bitter T., Muir H.M., 1962. Anal. Biochem., 4:330.
[6]. Żak I, Węglowodany , http://biochigen.slam.katowice.pl/podrecznik/10.pdf
Tagi: kwasy uronowe, GAG, glikozaminoglikany, metoda boranowa, siarczan chondroityny, metoda zmętnieniowa, kwas hialuronowy, hialuronian, ciałko szkliste oka, siarczan dermatanu, bufor octanowy, mieszanina trawiąca.
wstecz Podziel się ze znajomymi









Recenzje