- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Oznaczanie stężenia hemoglobiny glikowanej w diagnostyce cukrzycy
Termin glikacja odnosi się do wieloetapowego procesu zachodzącego spontanicznie bez udziału enzymów. W jej wyniku powstają zaawansowane końcowe produkty glikacji, które określane są skrótem AGE (ang. Advanced Glycation End-Products). Proces glikacji zachodzi zarówno w organizmach żywych, jak i in vitro [2]. Reakcje glikacji opatrzone są nazwą reakcji Maillarda. Nazwa wywodzi się od nazwiska francuskiego chemika Louisa-Camilla Maillarda, który jako pierwszy w 1919 rok badał reakcje pomiędzy cukrami, a białkami w produktach żywnościowych [2]. Cały proces glikacji zachodzi w organizmach żywych bardzo powoli, ponieważ tylko mała część glukozy występuje w postaci otwartej, zawierającej wolną grupę aldehydową, która może reagować z grupami aminowymi białek [6].
Glikacja jest główną przyczyną spontanicznych uszkodzeń białek. Proces ten jest szczególnie niekorzystny w przypadku cukrzycy- jako konsekwencja wzrostu glukozy i innych pochodnych sacharydów w osoczu [4]. W trakcie glikacji zachodzi reakcja grupy aldehydowej cząsteczki monosacharydu (zazwyczaj jest nią glukoza) z wolnymi grupami aminowymi różnych białek. W jej wyniku powstaje tzw. hemoglobina glikowana (GHB, glikohemoglobina). Spośród znanych kilku frakcji hemoglobiny glikowanej największe znaczenie diagnostyczne ma frakcja HbA1c (A1c) [11]. Reakcji tej ulegają wszystkie białka, w których cząsteczkach wyróżnia się wolne grupy aminowe. Wśród białek krwi znane są glikowane formy hemoglobiny, albuminy, lipoprotein oraz białek układu krzepnięcia. Ponadto, glikacji ulegają również białka strukturalne, takie jak kolagen i białka wewnątrzkomórkowe. Proces glikacji powoduje zmianę struktury i funkcji wielu białek,a także odgrywa istotną rolę w patogenezie przewlekłych powikłań cukrzycy [1].
Ilość powstających produktów glikacji białek zależy od stężenia substratów oraz lokalnych zmian pH. Z racji tego,że stężenia białek osocza i hemoglobiny są zwykle stałe, nasilenie glikacji tych białek jest wynikiem współdziałania dwóch czynników, tj.: średniego stężenia glukozy, a także czasu, w jakim białko było eksponowane na kontakt z cząsteczkami glukozy. Zależność pomiędzy stężeniem glukozy, a zawartością białek glikowanych stała się bardzo ważnym parametrem wykorzystywanym w monitorowaniu leczenia cukrzycy. W tym celu oznacza się hemoglobinę glikowaną oraz albuminę glikowaną (oznaczana jako fruktozaminę). Fruktozamina jest ketoaminową formą białka, która powstaje po przegrupowaniu cząsteczki utworzonej w wyniku reakcji glukozy z grupą aminową reszt lizynowych. Zazwyczaj oznaczana jest w przypadku, gdy występują trudności z oznaczeniem HbA1c lub u kobiet ciężarnych z cukrzycą [1], [12].
O poziomie AGE w ustroju decyduje nie tylko szybkość ich wytwarzania, lecz również tempo usuwania. W warunkach homeostazy AGE podlegają rozkładowi proteolitycznemu w lizosomach komórek, a powstałe produkty degradacji wydzielane są do krążenia i wydalane z moczem. Pewna ilość AGE może być również usuwana z krążenia przez wątrobę, za co odpowiedzialne są tzw. komórki Kupffera (stanowiące 15-20% wszystkich komórek wątroby) oraz śródbłonek tkanki wątroby [3].
Coraz częściej w rutynowej diagnostyce laboratoryjnej wykorzystuje się oznaczanie fruktozaminy z użyciem metody kolorymetrycznej, która oparta jest na redukcji błękitu nitratetrazoliowego. Metoda stosowana jest jako retrospektywny miernik glikemii ostatnich 2–3 tygodni (okres półtrwania albuminy) oraz glikowanej hemoglobiny (HbA1c). Z kolei, metody chromatograficzne z zastosowaniem jonowymiennych kolumn kationowych, stosowane są jako miernik glikemii ostatnich trzech miesięcy (okres życia erytrocytów) [2].
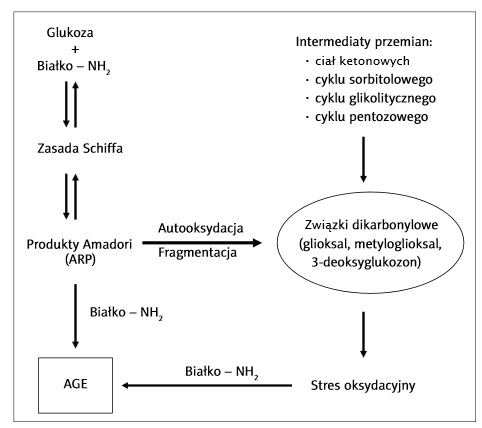
Zdjęcie: Schemat powstawania AGE w organizmie, http://www.ptfarm.pl/pub/File/Farmacja%20Polska/2010/08-2010/11%20%20AGE.pdf
Przygotowanie materiału do oznaczania hemoglobiny glikowanej
Do oznaczenia wykorzystywana jest pełna krew żylna, która pobierana jest na EDTA lub heparynę. Możliwe jest również przeprowadzenie badania w krwi włośniczkowej pobieranej do specjalnie heparynizowanych kapilar i probówek z czynnikiem hemolizującym. Oznaczenie frakcji HbA1c powinno być wykonywane jak najszybciej z racji tego, że glikacja zachodz również in vitro (jej stopień uzależniony jest od aktualnego stężenia glukozy) [11]. Pobrana krew może być też przechowywana- jednak nie dłużej niż tydzień w temp. +4°C. Dłuższe przechowywanie pełnej krwi (lub hemolizatu) powoduje późniejsze zakłócenia w oznaczaniu frakcji z wykorzystaniem metod chromatograficznych. [11].
Najczęściej występujące czynniki zakłócające oznaczanie frakcji HbA1c:
- obecnośc we krwi prekursora glikohemoglobiny tzw. pre-HbA1c (forma aldiminowa HbA1c). U osób zdrowych forma aldiminowa stanowi ok. 5%-8% całej puli hemoglobiny HbA1, zaś u osób z cukrzycą odsetek wzrasta i wynosi do 30% [11], [12].
- występowanie niedokrwistości hemolitycznej, niewydolności nerek i innych chorób powodujących skrócenie okresu życia erytrocytów
- wszelkiego rodzaju hemoglobinopatie (np. zwiększenie zawartości hemoglobiny płodowej HbF )
- warianty hemoglobiny powstające w wyniku stosowania leków, picia alkoholu lub w przebiegu mocznicy
- hiperbilirubinemia, hipertriglicerydemia [11], [12].
Metody oznaczania prekursorów AGE
Na rynku dostępne są różne zestawy testowe, które umożliwiają pomiar stężenia wczesnych produktów glikacji białek. Do najpowszechniej stosowanych technik oznaczania AGE w materiale biologicznym (takim jak surowica krwi czy mocz) zalicza się metody: spektrofluorescencyjne oraz immunoenzymatyczne. Dostępne są komercyjne testy typu ELISA do pomiaru stężenia prekursorów AGE (np. karboksymetylolizyny – CML). Inny prekursor -pentozydynę oznacza się najczęściej w moczu za pomocą wysokosprawnej chromatografii cieczowej (HPLC). Taka próbka nie wymaga hydrolizy, ponieważ występuje ona w moczu w formie wolnej, z kolei w osoczu większość pentozydyny jest związana z białkami i oznaczenie całkowitej zawartości wymaga uprzedniej hydrolizy [2].
Proces glikacji może zachodzić zarówno wewnątrz komórek, jak i pozakomórkowo we wszystkich tkankach i płynach ustrojowych. Należy podkreślić, że zjawisko glikacji dotyczy nie tylko białek, ale również DNA czy lipidów. W życiu płodowym obserwuje się duże ilości glikowanych białek w komórkach macierzystych [3]. W warunkach fizjologicznych proces glikacji przebiega powoli przez całe życie, stopniowo prowadząc do starzenia się organizmu. Reakcji glikacji zazwyczaj ulegają białka, które charakteryzują się długim okresie półtrwania. Wśród nich wyróżnia się: kolagen, krystalinę soczewki czy albuminę osoczową. Obecne w AGE wiązania krzyżowe przyczyniają się do wzrostu sztywności białek, a dalej wysokospolimeryzowane i usieciowane białka tracą swoje biologiczne funkcje. To z kolei utrudnia ich usuwanie z komórek i tkanek organizmu. Nieusunięte białka kumulują się w postaci złogów, powodując usztywnienie ścian naczyń oraz tkanek. Przeprowadzone badania wykazały postępujący wraz z wiekiem wzrost glikacji białek tkanki łącznej m.in. w ścięgnach i aorcie oraz nasiloną modyfikację kolagenu skóry u osób niewykazujących objawów cukrzycy. Zaobserwowane zjawisko wywiera bezpośredni wpływ na rozwój chorób związanych z wiekiem. Co więcej, wszystkie zmiany patofizjologiczne dodatkowo stymulowane są przez stres oksydacyjny, który towarzyszy powstawaniu AGE. Wykazano, że glikacja nasila się w stanie ostrej i chronicznej glikemii, dlatego też to właśnie w cukrzycy znacznie wcześniej dochodzi do akumulacji AGE w krążeniu oraz w różnych tkankach i narządach [3], [5]. Spośród białek, które ulagają nieenzymatycznej reakcji glikacji duże znaczenie w diagnostyce cukrzycy mają hemoglobina, albumina, kolagen i krystalina. Oznaczenie glikowanej hemoglobiny i albuminy jest istotne w diagnostyce hiperglikemii. Proces glikacji kolagenu i innych białek macierzy u chorych na cukrzycę prowadzi do sztywnienia ścian naczyń żylnych i tętniczych, zaś glikacja krystaliny soczewki oka sprzyja wytworzeniu się katarakty. Wciąż trwają badania mające na celu wynalezienie leku, który zapobiegałby procesowi glikacji. Jego odkrycie byłoby przełomem w terapii cukrzycy [7].
Wśród najczęście stosowanych metod oznaczania stężenia hemoglobiny glikowanej wyróżnia się:
1) Metody wykorzystujące różnice w ładunku: hemoglobina glikowana HbA1c oraz hemoglobina HbA wykazuja niewielkie różnice w punkcie izoelektrycznym. Przy odpowiednim pH obydwie hemoglobiny mają różne ładunki elektryczne, a dzięki temu możliwe jest ich oznaczanie z wykorzystaniem chromatografii jonowymiennej, chromatografii powinowactwa, elektroforezy czy ogniskowania izoelektrycznego [10], [1]. Chromatografia jonowymienna jest metodą rozdziału frakcji hemoglobiny, opierającą się na ładunku cząsteczek. W metodzie wykorzystywane są kationowe żywice jonowymienne. Związanie wolnych grup aminowych z cząsteczkami glukozy powoduje, że hemoglobina glikowana w środowisku kolumny chromatograficznej wykazuje mniejsz ładunek ujemny od hemoglobiny A. Znane są dwa rodzaje chromatografii jonowymiennej tj.: niskociśnieniowa oraz wysokociśnieniowa chromatografia cieczowa (określana jako HPLC). Z kolei, w chromatografii powinowactwa wykorzystywana jest pochodna kwasu borowego, która związana jest z podłożem wypełniającym kolumnę. W wyniku reakcji cząsteczki hemoglobiny glikowanej są wiązane kowalencyjnie przez wytworzenie pierścieniowego połączenia z udziałem atomu boru. W wyniku dysocjacji następuje elucja hemoglobiny glikowanej oraz pomiar stężenia w zebranej frakcji. Podobnie jak chromatografia jonowymienna, również wyróżnia się jej dwie odmiany (niskociśnieniową i wysokociśnieniową) [1].
2) Metody oparte o różnice strukturalne: hemoglobina HbA1c w przeciwieństwie do hemoglobiny A posiada glukozę połączoną z N-końcową waliną β-globiny. Zależność tą wykorzystuje się w oznaczaniu hemoglobin metodą chromatografii powinowactwa, immunochemiczną czy spektrometrią masową [10].
Oznaczanie glikowanej hemoglobiny (HbA1c) z wykorzystaniem zestawu odczynników Horiba ABX Pentra HbA1c WB i analizatora Pentra C200 (wg Urbaniak J. i Woźniak M., 2012).
Oznaczanie HbA1c w monitorowaniu leczenia cukrzycy rozpowszechniło się w latach 90-tych, kiedy to ogłoszono wyniki badań Diabetes Control and Complications Trial (DCCT) oraz United Kingdom Prospective Diabetes Study (UKPDS). W badaniach tych wykazano, że odsetek HbA1c jest nie tylko retrospektywnym wskaźnikiem wyrównania metabolicznego cukrzycy, lecz również niezależnym czynnikiem ryzyka rozwoju przewlekłych powikłań choroby. Dzięki temu, zgodnie z rekomendacjami towarzystw diabetologicznych (min. Polskiego Towarzystwa Diabetologicznego) zaczęto stosować oznaczanie hemoglobiny glikowanej u chorych na cukrzycę w momencie rozpoznania choroby, a następnie co 3 miesiące. W przypadku stabilnie przebiegającej, dobrze wyrównanej metabolicznie choroby , zaleca się wykonywanie oznaczeń HbA1c co pół roku [1].
Hemoglobina HbA1c wykorzystywana jest do wykrywania oraz do oceny ryzyka rozwoju cukrzycy u osób z upośledzoną tolerancją glukozy. Wciąż badane są nowe metody oznaczania HbA1c, gdyż jej rola w wykrywaniu cukrzycy wciąż rośnie. Co ważne, ten rodzaj hemoglobiny wykazuje mniejszą zmienność biologiczną w porównaniu do glikemii [8]. Ważne znaczenie ma fakt, że oznaczenie może być wykonywane w materiale pobranym o dowolnej porze dnia, niezależnie od spożywanych pokarmów czy aktywności fizycznej, co znacznie ułatwia prowadzenie badań [8].
Urbaniak J. i wsp. (2012) przeprowadzili badania mające na celu zbadanie przydatności krwi przechowywanej w postaci suchej kropli na bibule, w oznaczaniu hemoglobiny glikowanej HbA1c. Oznaczenie pzreprowadzono z wykorzystaniem metody immunoturbidymetrycznej. Do badań wykorzystano krew pobraną od 47 pacjentów, którą następnie nanoszono na bibułę typu Whatman 3. Tak przygotowane próbki suszono, a dalej przechowywano przez 24 godziny, 72 godziny lub 7 dni. Zawartość hemoglobiny glikowanej (HbA1c) we krwi pełnej i suchej kropli krwi oznaczano z wykorzystaniem gotowego zestawu odczynników (Horiba ABX Pentra HbA1c WB) przy użyciu analizatora Pentra C200 [8].
W swoich badaniach Urbaniak J. i wsp. (2012) wykorzystywali losowo wybrane próbki, które stanowiły krew żylną pobraną na wersenian. W próbkach tych w badaniach kontrolnych oznaczono stężenie HbA1c [8].
Wykonanie (wg Urbaniak J., Woźniam M., 2012)
Oznaczenie prób wykonywano w hemolizacie krwi wg instrukcji producenta dołączonej do zestawu odczynników.
1) 10 µl krwi pełnej zmieszano z 500 µl odczynnika lizującego (ABX Pentra WB Hemolysis Reagent). Próbkę dokładnie wymieszano, a następnie inkubowano 15 minut w temperaturze pokojowej. Po uplywie czasu inkubacji otrzymany hemolizat umieszczano w rotorze próbkowym aparatu i przeprowadzono analizę.
2) Równolegle nanoszono 20 μl każdej próbki badanej krwi pełnej na paski bibuły chromatograficznej typu Whatman 3MM, bibuły suszono, a następnie przechowywano przez 24 godziny , 72 godziny lub 7 dni w temperaturze pokojowej (w papierowych kopertach).
3) W kolejnym etapie suchą kroplę wycinano z bibuły (dzieląc ją na 3 części). Bibułę umieszczano w probówce typu Eppendorfa i dodawano do niej 500 μl odczynnika lizującego (tj. ABX Pentra WB Hemolysis Reagent). Po 15 minutowej inkubacji w probówce całość delikatnie mieszano. W ostatnim etapie otrzymany hemolizat przenoszono do naczyńka próbkowego analizatora i poddawano go analizie [8].
Zestaw ABX Pentra HbA1c WB (Horiba Ltd.)
Powyższy zestaw składa się z odczynników umożliwiających przeprowadzenie dwóch niezależnych oznaczeń. Tak więc, możliwe jest oznaczenie hemoglobiny całkowitej z wykorzystaniem metody kolorymetrycznej, jak również frakcji HbA1c metodą immunoturbidymetryczną. Oznaczanie hemoglobiny całkowitej polega na konwersji wszystkich form hemoglobiny w hematynę zasadową. Reakcja zachodzi w zasadowym roztworze detergentu niejonowego, a w jej wyniku dochodzi do zmiany barwy roztworu, której natężenie jest wprost proporcjonalne do stężenia hemoglobiny w badanej próbce. W metodzie immunoturbidymetrycznej wykorzystuje się agregację cząstek lateksu, które opłaszczone są przeciwciałami monoklonalnymi skierowanymi przeciwko HbA1c (anty-HbA1c) po dodaniu syntetycznego polimeru (zawierającego wiele kopii immunoreaktywnej HbA1c) [8],[9]. HbA1c z próbki pacjenta konkuruje o miejsca wiązania na cząsteczkach przeciwciała anty-HbA1c opłaszczonych na lateksie,w wyniku tego dochodzi do hamowania aglutynacji. W konsekwencji uzyskuje się mniejsze rozproszenie światła (spadek absorbancji) [10].Z kolei, tworzenie kompleksów w zawiesinie powoduje wzrost absorbancji (duże rozproszenie światła), gdzie po dodaniu próbki badanej aglutynacja odczynników testowych jest hamowana w stopniu zależnym od stężenia HbA1c w badanym materiale. Na podstawie otrzymanych wyników oblicza się odsetkową zawartość HbA1c , która stanowi stosunek HbA1c do hemoglobiny całkowitej [8], [9], [10].
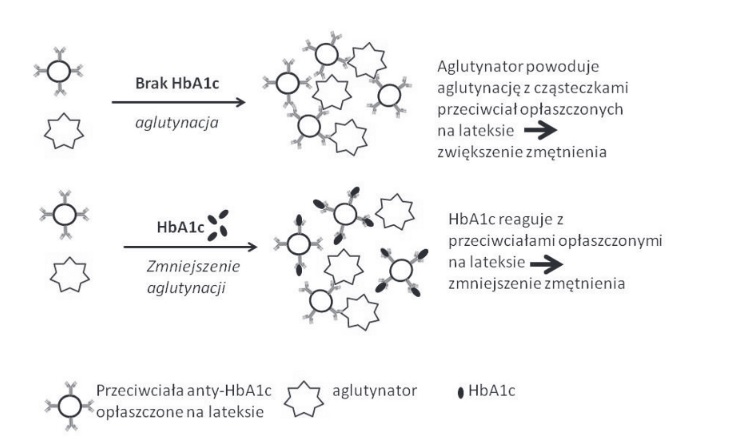
Zdjęcie: Metoda immunoturbidymetryczna oznaczania stężenia HbA1c, http://diagnostykalaboratoryjna.eu/journal/DL_3_2012._str_303-311.pdf
Oznaczanie hemoglobiny glikowanej metodą immunoturbidymetryczną (wg Lakshmy R., Gupta R.,2009)
Wykonanie:
Krew żylną pobrano do probówek zawierających antykoagulant (EDTA). Na bibułę Wathman (nr 3) nanoszono po 10 µl krwi za pomocą pipety, po czym suszono w temperaturze pokojowej. Po całkowitym wyschnięciu krążki bibuły pakowano do zamykanych plastykowych worków w celu ochrony przed kurzem i wilgocią. Tak przygotowane przechowywano w 4°C [9].
Z bibuły z krwią wycinano 6 mm krążki, a następnie szacowano ilość hemoglobiny glikowanej z wykorzystaniem metody immunoturbidymetrycznej (stosując zestaw Agappe Diagnostic, Indie). Wykorzystany kit opiera się na oddziaływaniu antygenu z przeciwciałem, gdzie bezpośrednio określana jest wartość A1c w krwi pełnej. W momencie dodania mysich monoklonalnych przeciwciał (anty-ludzkich A1c) do pełnej krwi dochodzi do formowania się kompleksu z cząsteczkami lateksu opłaszczonymi anty-ludzkimi przeciwciałami A1c. Oddziaływanie przeciwciał z krwi badanej i z zestawu powoduje aglutynację w próbce. Wielkość aglutynacji mierzona jest jako absorbancja, która jest proporcjonalna do ilości HbA1c zaabsorbowanej na powierzchni cząsteczek lateksu [9].
Jedną wyciętą suchą kroplę krwi (odpowiadającą 8 µl krwi) zmieszano z 400 µl odczynnika do hemolizy. Próbkę dokładnie wymieszano i inkubowano w temperaturze pokojowej przez 30 minut do całkowitego rozpadu. Otrzymany hemolizat poddano następnie inkubacji z odczynnikiem zawierającym opłaszczony przeciwciałami lateks, po czym do próbki dodano odczynnik zawierający mysie przeciwciało (anty-ludzkie przeciwciało A1c) oraz kozie przeciwciało anty-mysie IgG (przeciwciała poliklonalne) w buforze glicynowym. Próbki inkubowano, po czym zmierzono absorbancję przy 600 nm. Dla oszacowania stężenia całej krwi, hemolizat przygotowano przez 10 minutową inkubację 10 µl z 500 µl odczynnika do hemolizy. Reszta oznaczeń wykonywana była w sposób identyczny jak dla krwi suszonej na filtrze.
Badania przeprowadzone przez Lakshmy R. i wsp. (2009) z wykorzystaniem metody turbidymetrycznej, wykazały dobrą korelację między stężeniem HbA1c w próbce świeżej krwi, jak i utrwalonej w postaci plamy na filtrze (bibule typu Whatman). Jak pokazały przeprowadzone badania, hemoglobina glikowana może być z powodzeniem oznaczana w krwi utrwalanej, dzięki czemu można wyelimonować „czynniki przeszkadzające”, które towarzyszą pomiarom w krwi świeżo pobranej [9]
Autor: Lidia Koperwas
Literatura:
[1]. Solnica B. Oznaczanie hemoglobiny glikowanej w monitorowaniu leczenia cukrzycy. Katedra Biochemii Klinicznej, Collegium Medium, Uniwersytet Jagielloński, Kraków. http://diabetologiaonline.pl/lekarz_diabeto_adoz,info,67.html
[2]. Warwas M., Piwowar A., Kopiec G., 2010. Zaawansowane produkty glikacji (AGE) w organizmie- powstawanie, losy, interakcja z receptorami i jej następstwa. Patogeneza Chorób, Farmacja Polska. Tom 66, nr 8, 2010. http://www.ptfarm.pl/pub/File/Farmacja%20Polska/2010/08-2010/11%20%20AGE.pdf
[3]. Pietkiewicz J., Seweryn E., Bartyś A., Gamian A., 2008. Receptory końcowych produktów zaawansowanej glikacji – znaczenie fizjologiczne i kliniczne. Postepy Hig Med Dosw. (online), 2008; 62: 511-523. http://www.phmd.pl/fulltxthtml.php?ICID=870077
[4]. Ahmed N., Thornalley P.J., 2007. Advanced glycation endproducts: what is their relevance to diabetic camplications?. Diabetes Obes Metab. 2007 May;9(3):233-45. abstract: http://www.ncbi.nlm.nih.gov/pubmed/17391149?dopt=Abstract
[5]. Brett J. i wsp., 1993. Survey of the Distribution of a Newly Characterized Receptor for Advanced Glycation End Products in Tissues. Am J Pathol. Dec 1993; 143(6): 1699–1712. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1887265/?page=1
[6]. Kuzan A., Chwiłkowska A., Kobielarz M., Pezowicz C., Gamian A., 2012. Glikacja białek macierzy zewnątrzkomórkowej i jej znaczenie w miażdżycy. Postepy Hig Med Dosw. (online), 2012; 66: 804-809. http://www.phmd.pl/fulltxthtml.php?ICID=1016359
[7]. Jabłońska-Trypuć A., 2007. Artykuł poglądowy: Molekularny mechanizm nieenzymatycznej glikacji białek i jej rola w cukrzycy. Przegląd Kardiodiabetologiczny 2007; 2, 4: 253–258. http://www.termedia.pl/Artykul-pogladowy-Molekularny-mechanizm-nieenzymatycznej-glikacji-bialek-i-jej-rola-w-cukrzycy,47,9594,0,0.html
[8]. Urbaniak J., Woźniak M., 2012. Oznaczanie hemoglobiny glikowanej HbA1c w suchej kropli krwi – doniesienia wstępne. diagnostyka laboratoryjna Journal of Laboratory Diagnostics 2012 • Volume 48 • Number 1 • 51-55. http://diagnostykalaboratoryjna.eu/journal/DL_1_2012._str_51-55.pdf
[9]. Lakshmy R., Gupta R., 2009. Measurement of glycated hemoglobin 12. A1c from dried blood by turbidimetric immunoassay. J Diabetes Sci Technol 2009; 3: 1203-1206
[10]. Sztefko K., 2012. Hemoglobina glikowana- problem analityczne. diagnostyka laboratoryjnaJournal of Laboratory Diagnostics 2012 • Volume 48 • Number 3 • 303-311. http://diagnostykalaboratoryjna.eu/journal/DL_3_2012._str_303-311.pdf
[11]. Diabetologia Doświadczalna i Kliniczna, 2006. Tom 6, Suplement A. Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę, 2006. www.ddk.viamedica.pl
[12]. Szutowicz A., Raszei-Szpecht A., 2009. Diagnostyka laboratoryjna. Tom I.Gdański Uniwersytet Medyczny, Zlecenie KW/224/09.Recenzent prof. dr hab.Wiesława Łysiak-Szydłowska. s.244 -246.
Tagi: hemoglobina, hemoglobina glikowana, frakcja HbA1c, krew, diagnostyk, cukrzyca, glikacja, AGE, metody chromatograficzne, metoda immunoturbidymetryczna
wstecz Podziel się ze znajomymi









Recenzje