Streszczenie
Związki kompleksowe mogą mieć bardzo różną strukturę, a tym samym geometrię cząsteczki. Jednak analizując parametry widma spektroskopowego można dokładnie zdefiniować te właściwości.
Pomiary spektroskopowe związków kompleksowych służą zatem nie tylko do pomiaru absorbancji przy konkretnych długościach fali, ale pozwalają wyznaczyć strukturę i geometrię kompleksu.
Wprowadzenie
Związki kompleksowe jest to specyficzna grupa związków złożona z: rdzenia (jednego lub kilku) oraz ligandów. Rdzeniem jest najczęściej jon metalu przejściowego, zaś ligandy to skoordynowane przez atom centralny jony lub cząsteczki elektroobojętne, które otaczają rdzeń. Rdzeniem (atomem centralnym) jest zwykle atom lub jon, który jest akceptorem par elektronowych. Ligandy to cząsteczki lub jony dysponujące wolnymi parami elektronów – donory par elektronowych. Powstałe wiązania koordynacyjne zbliżają konfigurację atomu centralnego do konfiguracji najbliższego gazu szlachetnego. Liczba ligandów otaczających atom centralny zwana jest liczbą koordynacyjną.
Związki kompleksowe występują:
- w fazie stałej – tworzą w sieć krystaliczną związku,
- w roztworze
Mechanizm tworzenia wiązania koordynacyjnego i oddziaływa atomu centralnego z ligandami wyjaśniają liczne teorie. Do najpopularniejszych zalicza się : teorię pola krystalicznego (zakłada oddziaływania elektrostatyczne pomiędzy elektronami podpowłoki d atomu centralnego a wolnymi parami elektronów ligandu) oraz teoria pola ligandów (wiązanie koordynacyjne powstaje w wyniku nakrywania się orbitali atomowych ligandów obsadzonych wolnymi parami elektronowymi). Inne zależności występujące w kompleksach przedstawiono w poniższej tabeli.
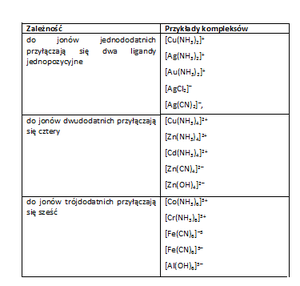
Tab. 1. Ładunek atomu centralnego, a rodzaj ligandu
Zagodnie z regułą Lamberta liczba koordynacyjna jest funkcja okresu np. dla drugiego okresu LK = 4, dla trzeciego i czwartego – LK = 6, a piatego i szóstego – LK = 8.
Struktura kompleksu
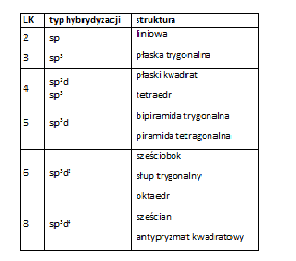
Struktura przestrzenna kompleksu jest warunkowana liczbą koordynacyjną. W budowie kompleksów ważna jest również hybrydyzacja orbitali atomu centralnego. Większość metali tworzących kompleksy to metale grup przejściowych, które charakteryzują sie zapełnianiem orbitalu d przedostatniej powłoki elektronowej. Zapełnione orbitale są zdolne do hybrydyzacji z orbitalami s oraz orbitalami p powłoki walencyjnej W wyniku tych oddziaływań tworzą się hybrydyzowane orbitale wiążące. Typ hybrydyzacji zależy od ilości elektronów d. Typ hybrydyzacji warunkuje strukturę kompleksu (Tab. 2).
Tab. 2. Typ hybrydyzacji a geometryczna struktura kompleksu
Struktura ligandu jest także warunkowana strukturą samego ligandu. Ligandy posiadające wiele atomów mogących być donorem elektronów nazywamy ligandem wielopozycyjnym lub chylatowym (kleszczowym).
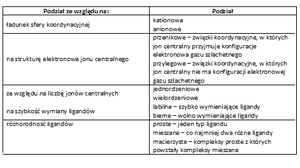
Tab. 3 Podział związków kompleksowych
Energia pola powstała na skutek oddziaływania elektronów ligandów z orbitalami d atomu metalu zmienia się. Zwiększenie tej energii następuje, gdy pole wytworzone przez ligandy (ligandów obojętne i anionowe) jest sferycznie symetryczne. W skutek tego procesu orbitale d posiadają taka sama energie. W strukturach oktaedrycznych i teraedrycznych i pole wytworzone przez ligandy nie jest sferycznie symetryczne, nie oddziałuje w taki sam sposób na wszystkie orbitale d. Ligandy tzw. osiowe (leżące na osi) zwiększają bardziej energie „osiowych” orbitali d a w mniejszym stopniu energie orbitali d mieszanych (leżących pomiędzy osiami).Wynikiem tego zjawiska jest rozszczepienie poziomów energetycznych orbitali d na dwie grupy – orbitale o wyższej i niższej energii. Rozczepienia te zależą od pola wytworzonego przez ligandy.
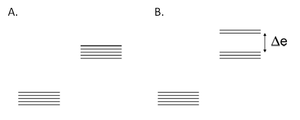
Rys. 1. Rozczepienie orbitali d metali przejściowych: A. zwiększenie energii orbitali d metalu przejściowego na skutek oddziaływania ze sferycznie symetrycznym polem wytworzonym przez ligandy; B. rozszczepienie energii orbitali d metalu przejściowego na skutek oddziaływania z oktaedrycznym polem wytworzonym przez ligandy.
W stanie podstawowym jonu obsadzone są elektronami orbitale d o najniższej energii. Elektron ten może pochłonąć kwant promieniowania i zająć orbital d o wyższej energii. Wartość przerwy energetycznej orbitali d odpowiada długości promieniowania widzialnego, na skutek absorpcji jednej z długości fali związki kompleksowe posiadają barwę. Szerokość pasma pomiędzy rozszczepionymi orbitalami d decyduje o barwie kompleksu. Badając widmo promieniowania elektromagnetycznego danego kompleksu, na podstawie położenia maksimum absorpcji, można łatwo zmierzyć wartość przerwy energetycznej.
Analiza właściwości spektroskopowych
W rozważaniach właściwości spektroskopowych związków kompleksowych symetria otoczenia atomu centralnego ma bardzo ważne znaczenie, gdyż determinuje liczbę i rodzaj poziomów energetycznych, a tym samym możliwe przejścia elektronowe.
Rozpatrując kompleks o liczbie koordynacyjnej 5 możliwa jest symetria: bipiramidy trygonalnej oraz piramidy trygonalnej. W wyniku zniesienia degeneracji orbitalnej, następuje wzrost ilości poziomów energetycznych, powodując tym samym wzrost liczy przejść między termami a takiej samej multipletowości. Liczba koordynacyjna 5 w konfiguracji d9(d1) atomu centralnego daje zatem dodatkowe pasmo (850 nm), często o bardzo małym współczynniku absorpcji. Powoduje to, iż w takich badaniach najczęściej analizuje się pogłębianie asymetrii mierzonego pasma oraz jego poszerzania. W wyniku oddziaływania ze struktura kompleksu cząsteczek wody (często w pozycjach aksjalnych) następuje przesunięcie maksimum absorpcji w kierunku fal dłuższych. Ogromny wpływ na pomiary spektroskopowe kompleksów ma pH środowiska.
Autor: Karolina Wójciuk
wstecz
Podziel się ze znajomymi










Recenzje