- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Wybrane metody oznaczania zawartości kwasów nukleinowych cz.II
 Metody chemiczne stosuje się do oznaczania ilościowego kwasów nukleinowych w preparatach izolowanych z tkanek, jak i do ilościowego określania zawartości tych związków w tkankach bez wcześniejszego wydzielania (izolacji) kwasów nukleinowych. W tym celu przed przystąpieniem do zastosowania danej metody chemicznej, najpierw stosuje się tzw. frakcjonowanie wstępne [3].
Metody chemiczne stosuje się do oznaczania ilościowego kwasów nukleinowych w preparatach izolowanych z tkanek, jak i do ilościowego określania zawartości tych związków w tkankach bez wcześniejszego wydzielania (izolacji) kwasów nukleinowych. W tym celu przed przystąpieniem do zastosowania danej metody chemicznej, najpierw stosuje się tzw. frakcjonowanie wstępne [3].Słowa kluczowe: metody chemiczne, frakcjonowanie związków fosforowych, wstępna ekstrakcja, metoda Schmidta i Thannhausera, metoda Schneidera, metoda Ogura i Rosen, absorbancja.
Znanych jest wiele metod frakcjonowania związków fosforowych, z wyodrębnieniem frakcji zawierającej kwasy nukleinowe, przy czym najbardziej znana ( w odniesieniu do tkanek i komórek pochodzenia zwierzęcego) jest technika Schmidta i Thannhausera (1945 r.), oraz jako druga technika Schneidera (1945 r.). Obydwie metody, pomimo wielu różnych modyfikacji są stosowane do dziś. Jeżeli zaś chcemy oznaczać zawartość DNA i RNA w materiale pochodzenia roślinnego, to bardzo przydatna jest technika opracowana przez Ogura i Rosen z 1950 roku [3].
Cechą łączącą wszystkie wymienione metody jest to, że w każdej z nich stosuje się wstępną ekstrakcję związków fosforowych rozpuszczalnych w kwasie, wśród których są wszystkie małocząsteczkowe połączenia organiczne, np. wolne nukleotydy o różnym stopniu ufosforylowania, estry (heksozo- i triozo fosforowe, fosfoenolopirogronian, acetylofosforan i inne), jak również nieorganiczne orto- , meta- i pirofosforany. Z kolei nierozpuszczalna w kwasi pozostałość tkankowa jest źródłem fosfolipidów, kwasów nukleinowych oraz fosfoprotein, w związku z czym przed zanalizowaniem kwasów nukleinowych przeprowadza się najpierw ekstrakcje lipidów. Zarówno związki rozpuszczalne w kwasach jak i związki lipidowe mogą być także osobno badane, stosując w tym celu odrębne analizy [3].
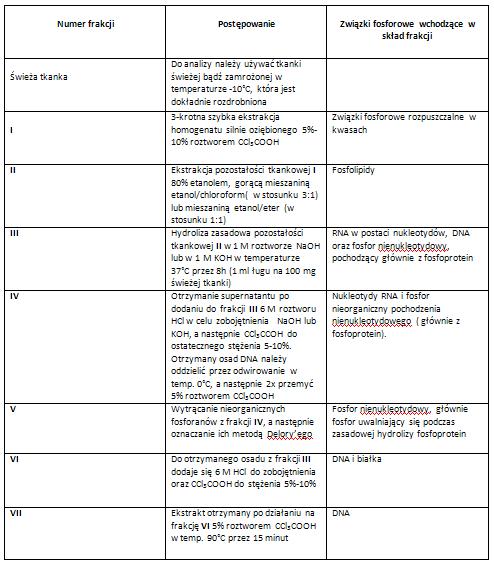
Oznaczanie zawartości kwasów nukleinowych- metoda Schmidta i Thannhausera [3].
W metodzie tej RNA oddziela się od DNA oraz większości białek występujących w tkance, po hydrolizie w 1 M roztworze NaOH lub KOH, przeprowadzonej w temperaturze 37˚C w ciągu jednej nocy (w alternatywnie 8 godzin). W zastosowanych warunkach RNA ulega hydrolizie do nukleotydów, z kolei DNA obecne w preparacie pozostaje nierozłożone. W takich warunkach część fosfory fosfoproteidów odszczepia się w postaci fosforanu nieorganicznego. Osad zawierający DNA i białka można wydzielić po wcześniejszym zakwaszeniu zasadowego hydrolizatu (III) za pomocą kwasu solnego lub trichlorooctowego. Po tym zabiegu RNA pozostaje w roztworze w postaci nukleotydów rozpuszczalnych w kwasach. Tak więc zarówno RNA jak i DNA można oznaczyć na podstawie zawartości fosforu w otrzymanych frakcjach (IV i VI), jednakże czułość oznaczenia zależy od czułości metody oznaczania fosforu [1], [3].
W przypadku małej zawartości fosforu nieorganicznego, który pochodzi z fosfoprotein we frakcji (IV), oznaczoną zawartość całkowitego fosforu można uważać w przybliżeniu za odzwierciedlenie ilości RNA. Dokładniejsze oznaczenie zawartości RNA można otrzymać po wytrąceniu nieorganicznych fosforanów z frakcji IV, wtedy to ilość fosforu RNA oblicza się na podstawie różnicy zawartości we fakcjach IV i V. Jest to ważne przede wszystkim w przypadku tkanek bogatych w fosfor nierozpuszczalny w kwasach i pochodzący nie z nuklein, np. tkanki wątroby lub mózgu (zarówno substancji białej jak i szarej). W celu wytrącenia nieorganicznych fosforanów często stosuje się metodę Delory’ego (1938) [3].
Główną zaletą metody jest możliwość oddzielenia DNA od RNA, co następnie stwarza możliwość oznaczania ich poprzez oznaczenie fosforu, cukru bądź puryn i pirymidyn. Wśród wad metody wymienia się fakt, że fakcja I (odpowiadająca RNA) zawiera związki, które nie są nukleotydami. Ze względu na to, że oznaczenie opiera się na analizie fosforu, zawsze istnieje tendencja do otrzymywania wyników, które są zbyt wysokie. Nienukleotydowe połączenia fosforowe we frakcji I mogą stanowić do 25% całkowitego fosforu tej frakcji w wątrobie, z kolei w tkance nerwowej nawet do 80%. Zawierają one fosfopeptydy i fosforany inozytu . Ponadto, nukleotydy mogą być z łatwością oddzielone od związków towarzyszących i otrzymane w stanie czystym, dzięki zastosowaniu elektroforezy bibułowej, a następnie oznaczane oddzielnie [1].
Inną wadą towarzyszącą tej metodzie jest tendencja do rozkładu DNA w niektórych tkankach, a następnie przesuwania go do frakcji RNA, przy czym zjawisko to zmienia się w zależności od rodzaju tkanki i gatunku zwierzęcia i jest np. o wiele wyraźniejsze w grasicy cielęcej niż w grasicy królika [1].
Oznaczanie fosforu może być przeprowadzone wieloma różnymi metodami analitycznymi m.in. metodą Fiskego i Subbarowa, bądź Allena, Griswolda i innych. Z kolei, metoda Berenbluma i Chaina nadaje się do analizy bardzo małych ilości tkanki (jak np. kultury fibroblastów in vitro), w których ilość oznaczanego fosforu jest rzędu 1μg. Dużo bardziej czułe metody oznaczania fosforu zostały opisane przez Norberg (dolna granica 0,5μg fosforu) oraz Engström, która oznacza całkowity fosfor w jednej komórce, jednakże metody te nie są związane ze sposobem rozdzielania kwasów nukleinowych według Schmidta i Thannhausera [1].
Aktualnie znanych jest wiele modyfikacji metody Schmidta i Thannhausera. Zazwyczaj ma to na celu zwiększenie czułości oznaczeń, np. w przypadku gdy zawartość DNA w danej tkance jest niewielka, wtedy też zaleca się wprowadzenie 1% roztworu albuminy jaja, co w konsekwencji powoduje łatwiejsze formowanie się osadu. Ponadto, czułość tej metody zwiększana jest przez wprowadzenie spektrofotometrycznych oznaczeń kwasów nukleinowych. Wtedy to we wszystkich etapach frakcjonowania stosuje się roztwory HCLO4, które w przeciwieństwie do roztworów CCl3COOH wykazują niewielki stopień pochłaniania długości fali w zakresie od 257 do 270 nm. Jedną z takich modyfikacji jest metoda Markova i Tsaneva (1960). Dodatkowo zawartość kwasów nukleinowych oznaczonych metodą Schmidta i Thannhausera można także wyliczyć z ilości nukleotydów, które rozdzielone są za pomocą chromatografii lub elektroforezy [3].
Wśród wprowadzonych modyfikacji metody bardzo korzystne okazało się zmienienie kolejności odlipidowania i odmywania związków w rozpuszczalnych kwasach (najpierw przeprowadza się odlipidowanie) wprowadzone przez Niemierkę (1953). Pozwala to na przechowywanie odlipidowanego materiału do dalszych badań, bez rozłożenia frakcji rozpuszczalnej bądź nierozpuszczalnej w kwasach. Zmieniony sposób odlipidowania (tj. aceton/chloroform w stosunku 5:1 w temperaturze 0˚C, a następnie etanol/eter w stosunku 3:1 w temperaturze 37˚C) sprawia, że materiał jest odwodniony [3].
Tabela: Sposób postępowania preparatywnego w metodzie Schmidta i Thannhausera- frakcjonowanie związków fosforowych [3].
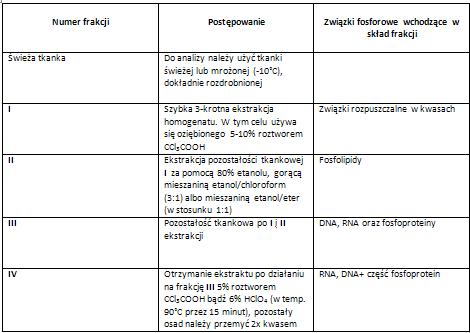
Oznaczanie zawartości kwasów nukleinowych metodą Schneidera [3].
W metodzie tej RNA i DNA są równocześnie ekstrahowane za pomocą gorącego (90˚C) roztworu CCl3COOH lub HClO4, które uwalniają kwasy nukleinowe od znacznej części białka, które wchodzi w skład frakcji nierozpuszczalnej w kwasach [3].
W trakcie ogrzewania kwasy nukleinowe ulegają rozpadowi, a następnie przechodzą do kwaśnego roztworu- jako już rozpuszczalne produkty (frakcja III) [1]. Ze względu na to, że podczas takiej ekstrakcji kwasy nukleinowe (zarówno DNA jak i RNA) rozpadają się do nukleotydów lub swobodnych zasad, niemożliwe jest ich rozdzielenie, można je oznaczać tylko za pomocą specyficznych metod na rybozę i deoksyrybozę [3].
Przeprowadzone badania wykazały dużą zgodność z oznaczeń DNA i RNA według metody Schneidera z oznaczeniami za pomocą metody Schmidta i Thannhausera dla większości tkanek zwierzęcych ( w tym dla trzustki, śledziony, grasicy, leukocytów oraz retikulocytów). Podczas oznaczenia wykonanego na tkance mózgowej i nerwowej otrzymano zaś duże różnice wyników. Przyczyną tego mogą być znaczne ilości fosfoprotein, oraz kompleksów białek z inozynofosforanami. Dobre rezultaty otrzymuje się wówczas dzięki zastosowaniu obu metod analizy, a następnie uzupełnieniu ich o oznaczenie pochłaniania w nadfiolecie [3].
W zmodyfikowanej metodzie Schneidera zamiast kwasu trójchlorooctowego używa się kwas nadchlorowy. Główną zaletą tej metody jest jej szybkość i łatwość stosowania, z kolei główną wadą jest fakt, że zarówno DNA jak i RNA nie są rozdzielane, a ich oznaczenie może być wykonane tylko przy pomocy zastosowania reakcji barwnych (swoistych dla pentozy i deoksypentozy, a wynik z kolei zależą od wielu zmiennych czynników) [1].
Należy zaznaczyć, że stosując tą metodę możliwe jest oznaczanie większej ilości fosfoproteidów ( prawie dziesięć razy więcej) , niż w przypadku posługiwania się metodą Schmidta i Thannhausera [1]. Przedstawioną metodę można zastosować do analizy ilości rzędu paru miligramów lub nawet paru mikrogramów wyjściowego materiału tkanki [1].
Tabela: Sposób postępowania preparatywnego w metodzie Schneidera- frakcjonowanie związków fosforowych [3].
W roślinach stężenie kwasu nukleinowego jest znacznie niższe niż np. w tkankach zwierzęcych, ponadto występuje w nich wiele różnych związków powodujących zakłócenia podczas izolacji, np. polisacharydy i inne. Tak więc, oprócz szczególnie korzystnych do izolacji i bogatych w kwasy nukleinowe zarodków pszenicy, istnieje tylko fragmentaryczna wiedza na temat normalnych kwasów nukleinowych tkanek roślinnych [2].
Kwas nukleinowy został po raz pierwszy wyizolowany z zarodków pszenicy przez Osborne i Campbell w 1900 roku. Z korzenia jęczmienia po raz pierwszy wyizolowano i scharakteryzowano kwas nukleinowy w 1943-1944 roku przez Takasugi. Z kolei poprawiona procedurę do izolacji z zarodka pszenicy zastała podana przez Lusena (1951). Dezoksypentozy kwasu nukleinowego (DNA) wydzielili z jąder komórkowych zarodków żyta Feulgen, Behrens i Mahdihassan w 1937 roku. Mirsky i Pollister (1946) selektywnie wyodrębnili pentozy nukleoproteiny z tkanek zwierzęcych z wykorzystaniem 0,14 M chlorku sodu [2].
Thomas i Sherratt (1956) w swoich doświadczeniach do izolacji frakcji kwasów nukleinowych wykorzystali różne tkanki roślinne, a m.in. tkanki pochodzące z paproci pospolitej, koniczyny, kapusty czy buraka cukrowego [2].
W wyniku frakcjonowania w przeprowadzonego doświadczenia (Thomas i Sherratt, 1956) otrzymano między innymi frakcje deoksypentozy, gdzie preparaty DNA zawierały ok. 20-60% DNA, przy założeniu, że DNA zajmuje ok. 10% fosforu. Najlepsze preparaty zostały uzyskane z materiału pochodzącego z kapusty i koniczyny [2].
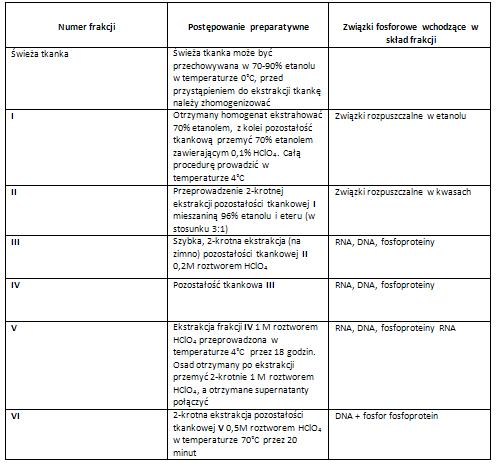
Metoda Ogura i Rosen [3].
Postępowanie preparatywne metody Ogura i Rosen zostało opracowane do oznaczania kwasów nukleinowych (DNA i RNA) w ilości rzędu 1 μg w stożkach wzrostu korzeni roślin oraz w pylnikach. Opisane powyżej metody są nieprzydatne do materiału roślinnego, ze względu na występowanie związków przeszkadzających w oznaczeniach, wśród nich np. pentozanów, poliuronidów. Przeprowadzenie wstępnego ekstrahowania tkanki etanolem i mieszanina etanolu z eterem (frakcja I i II) pozwala na oddzielenie rozpuszczalnych w nich związków, które w połączeniu z difenyloaminą dają intensywne purpurowe zabarwienie. Podczas ekstrakcji części nierozpuszczalnej w kwasach (IV) za pomocą 1 M roztworu HClO4 w temperaturze 4˚C wyodrębnia się jedynie RNA, którego zawartość można oznaczyć na podstawie absorbancji ekstraktu przy 260 nm, albo określenia ilości fosforu. Następnie z pozostałości tkankowej ekstrahuje się DNA ( za pomocą gorącego roztworu HClO4, a dalej oznacza ilościowo badając absorbancję przy 270 nm lub zawartość deoksyrybozy albo fosforu [3].
Zawartość kwasów nukleinowych może być oznaczana na podstawie zawartości fosforu , pentozy bądź deoksypentozy lub puryn i pirymidyn. Główną wadą tej metody jest fakt, że niektóre rodzaje DNA ulegają wymyciu podczas zastosowania zimnego kwasu nadchlorowego, w wyniku czego pojawiają się one we frakcji RNA [1].
Metoda Ogura i Rosen nie może być stosowana do wszystkich rodzajów tkanek, ponieważ nie dostarcza dobrych wyników analizy np. podczas ekstrakcji RNA z drożdży równocześnie wymywa się część DNA. Ponadto badając materiał pochodzenia bakteryjnego ta techniką, należy znacznie wydłużyć czas ekstrakcji RNA- nawet do 30 godzin. Metoda Ogura i Rosen może być także z powodzeniem stosowana do oznaczania kwasów nukleinowych w tkankach zwierzęcych. Wtedy to DNA ekstrahuje się 1 M kwasem nadchlorowym w temperaturze 80˚C przez 30 minut [1], [3].
Tabela: Postępowanie preparatywne według techniki Ogura i Rosen- frakcjonowanie związków fosforowych [3].
Literatura:
[1]. Davidson J.N, F.R.S, 1969. The Biochemistry of the Nucleic Acids, Six Edition , 1969; s. 110-112.
[2]. Thomas A.J., Sherratt S.A., 1956. The Isolation of Nucleic Acid Fractions from Plant Leaves and their Purine and Pyrimidyne Composition, Bioch.1956, Vol.62, s. 1-4
[3]. Kłyszejko-Stefanowicz L, 2003. Ćwiczenia z biochemii. Wydawnictwo Naukowe PWN, 2003, s. 347-351
[4]. Słomski R, 2008. Analiza DNA, teoria I praktyka. Wydawnictwo Uniwersytetu Przyrodniczego w Poznaniu, Poznań 2008. S.61-64
Tagi: metody chemiczne, frakcjonowanie związków fosforowych, wstępna ekstrakcja, metoda Schmidta i Thannhausera, metoda Schneidera, metoda Ogura i Rosen, absorbancja, lab, laboratoria, laboratorium
wstecz Podziel się ze znajomymi









Recenzje