Nanopakiet niszczący hipoksyczne komórki raka
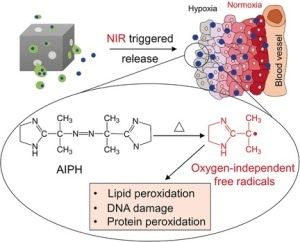 Większość guzów nowotworów złośliwych zawiera regiony o niskim stężeniu tlenu, w których terapie raka oparte o działanie reaktywnych form tlenu są nieskuteczne. W ostatnim czasie amerykańscy badacze opracowali hybrydowy nanomateriał, który rozładowuje prolek generujący wolne rodniki w obrębie komórek guza przy aktywacji termicznej.
Większość guzów nowotworów złośliwych zawiera regiony o niskim stężeniu tlenu, w których terapie raka oparte o działanie reaktywnych form tlenu są nieskuteczne. W ostatnim czasie amerykańscy badacze opracowali hybrydowy nanomateriał, który rozładowuje prolek generujący wolne rodniki w obrębie komórek guza przy aktywacji termicznej.
W magazynie Angewandte Chemie donoszą, że wolne rodniki likwidują komponenty komórki nawet w warunkach niedoboru tlenu, wywołując apoptozę. Dostarczenie, rozładowanie oraz działanie materiału hybrydowego mogą być precyzyjnie kontrolowane.
Szereg czołowych schematów leczenia raka jest opartych o wytwarzanie reaktywnych form tlenu (z ang. reactive oxygen species, ROS), które uruchamiają apoptozę komórek guza. Jednak system ten funkcjonuje wyłącznie w obecności tlenu, a obszary hipoksyczne (o obniżonej obecności tlenu) w tkance guza regularnie przeżywają leczenie oparte o ROS. W związku z tym Younan Xia z Georgia Institute of Technology (Instytutu Technologii w Georgii) i Emory University w Atlancie wraz ze swoim zespołem opracował strategię transportu i rozładowania generującego wolne rodniki proleku, który po aktywacji niszczy komórki za pomocą mechanizmu rodnikowego typu ROS, jednak nie wymagając tlenu.
Autorzy badania tłumaczą, że musieli przyjrzeć się chemii polimeryzacji, aby znaleźć związek, który wytwarza dostateczne rodniki. Uznanym inicjatorem polimeryzacji w tej dziedzinie jest związek azowy AIPH. W zastosowaniach terapeutycznych wytwarza wolne rodniki alkilowe, które wywołują zniszczenie DNA oraz peroksydację lipidów i białek w komórkach, nawet w warunkach hipoksji. AIPH musi jednak zostać precyzyjnie dostarczony do komórek w tkance. W związku z tym badacze wykorzystali nanoklatki, do jam których załadowali kwas laurynowy, tak zwany materiał zmiennofazowy (z ang. phase-change material, PCM), który może działać jako przenośnik dla AIPH. Po tym jak znajdą się w obrębie tkanki docelowej, naświetlanie laserem w bliskiej podczerwieni podgrzewa nanoklatki, wywołując stopienie PCM i aktywację rozładowania i rozkładu AIPH.
Koncept ten wykazywał dobre działanie, co zostało zademonstrowane przez zespół za pomocą szeregu eksperymentów na różnych typach komórek i komponentach. W przypadku krwinek czerwonych obserwowano zaznaczoną hemolizę. Komórki raka płuc integrowały nanocząsteczki i ulegały ciężkiemu uszkodzeniu przez aktywowane uwalnianie rodnikowego startera. Po leczeniu filamenty aktynowe ulegały wycofaniu i kondensacji. Komórki raka płuc wykazywały znaczącą inhibicję szybkości swojego wzrostu, niezależnie od stężenia tlenu.
Chociaż autorzy przyznają, że „skuteczność w dalszym ciągu musi zostać poprawiona poprzez optymalizację wykorzystywanych komponentów i warunków,” wykazali efektywność swojego hybrydowego systemu w destrukcji komórek, również w miejscach, w których występuje minimalny poziom tlenu. Strategia ta może być bardzo stosowna w teranostyce raka, nanomedycynie, a także zastosowaniach, w których pożądane jest ukierunkowane dostarczenie i kontrolowane rozładowanie przy doskonałych rozkładach w przestrzeni/czasie.
Źródło: http://www.azonano.com/news.aspx?newsID=35555
wstecz Podziel się ze znajomymi








