Hydrożel do podawania nierozpuszczalnych leków
Bioinżynier Jeffrey Hartgerink wraz ze swoimi studentami opracował strukturę hydrożelu w formie nanowłókna peptydowego zwanego "ubytkiem uzębienia." Prześwity pomiędzy kolejnymi włóknami mają za zadanie zatrzymywać cząsteczki leków o właściwościach hydrofobowych, czyli zdolnych do wypierania cząsteczek wody. Biodegradowalny żel można wstrzykiwać w żądanej lokalizacji celem uwolnienia lekarstwa w określonym czasie.
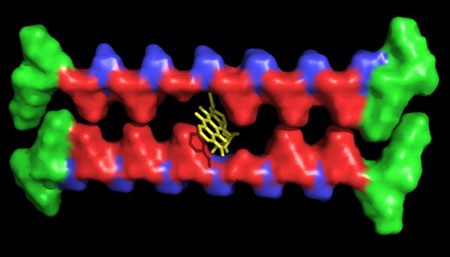
Hydrożel opracowany w Uniwersytecie Rice zawierający typowe włókna peptydowe z pustymi przestrzeniami - "ubytkami uzębienia" – zachowujące zdolność do chwytania i podawania leków o niewielkich cząstkach hydrofobowych. (Reprodukcja: I-Che Li/Rice University)
Hydrożele zbudowane z typowych peptydów okazują się być specjalnością laboratorium Hartgerinka, gdyż w ciągu ostatnich lat opracowano tam różne wersje metody wzrostu tkanek oraz ich leczenia dzięki wykorzystaniu możliwości wywoływania krzepnięcia syntetycznego jadu węża.
Nowe opracowanie Hartgerinka oraz absolwentów Uniwersytetu Rice - I-Che Li oraz Amandy Moore – dotyczy podawania leków, które wykazują tendencje do zbrylania, przez co napotyka się na problemy z ich podawaniem do krwiobiegu.
"Hydrofilowe (przyciągające cząsteczki wody) cząsteczki najczęściej nie potrzebują stosowania mechanizmu podawania, gdyż można je wstrzykiwać," twierdzi Hartgerink. "Ponieważ rozpuszczają się one w wodzie, łatwo jest podawać je do krwiobiegu. Jednak o wiele bardziej skomplikowana wydaje się być sprawa z lekami hydrofobowymi. Podajemy je do szczelin występujących w omawianych włóknach, dzięki czemu można je w dalszej kolejności przenosić do dowolnych lokalizacji, do których wstrzykuje się hydrożel."
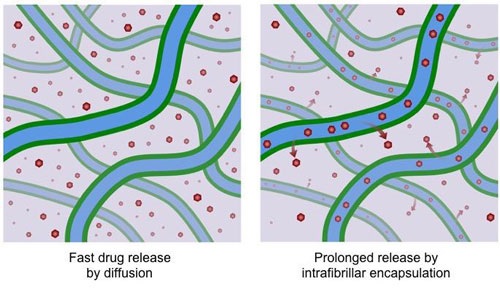
Fast drug release by diffusion – Szybkie uwalnianie leku na drodze dyfuzji;
Prolonged release by intrafibrillar encapsulation – Wydłużone uwalnianie leku na drodze międzywłókienkowego kapsułkowania.
Hydrożel opracowany w Uniwersytecie Rice służy do chwytania drobnych cząstek leków w przestrzeniach hydrofobowych wewnątrz jego włókien składowych. Wcześniejsze hydrożele uwalniały swój ładunek znacznie szybciej w wyniku dyfuzji, podczas gdy "szczerbate" hydrożele charakteryzują się wydłużonym okresem jego uwalniania do otaczającego środowiska. (Reprodukcja: I-Che Li/Rice University)
We wcześniejszych hydrożelach otrzymywanych w warunkach laboratoryjnych, białka lub drobne cząsteczki były przechwytywane przez struktury żelu uzyskiwane z mikroskopijnych włókien. "Dokonaliśmy czegoś zupełnie innego: Zmodyfikowaliśmy część wewnętrzną włókien," potwierdził. "Usunęliśmy wewnętrzną część włókna – stanowiącą ubytek w uzębieniu – stanowiącą środowisko hydrofobowe."
Aby uzyskać włókna o żądanej strukturze w warunkach laboratoryjnych w pierwszej kolejności opracowano typowe peptydy z występującymi na przemian hydrofobowymi oraz hydrofilowymi aminokwasami a następnie pozostawiono w ich strukturze puste przestrzenie. Leki o drobnych cząsteczkach hydrofobowych wymieszano z peptydami w celu ich przyłączenia do wspomnianych przestrzeni oraz pochwycenia, dzięki czemu uzyskano peptydy tworzące włókna o strukturze szczęki.
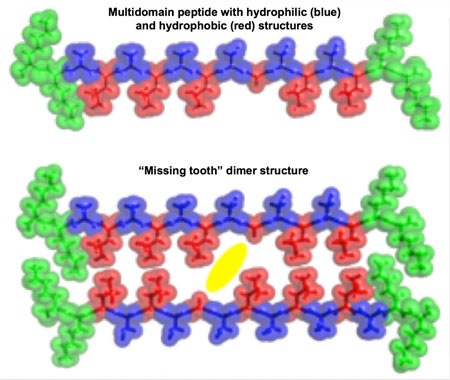
Multidomain peptide [...] – Wieloelementowy peptyd zawierający struktury hydrofilowe (niebeskie) oraz hydrofobowe (czerwone);
„Missing tooth” [...] – Struktura „szczerbatego” dimeru.
Peptydy otrzymane w Uniwersytecie Rice, które na jednej stronie posiadają struktury hydrofilowe (niebieskie) a na drugiej hydrofobowe (czerwone), w naturalny sposób tworzą roztwór zmieniający się w hydrożel. Puste przestrzenie pozostawione w strukturach hydrofobowych tworzą miejsca („ubytki uzębienia”), w których leki o drobnych cząsteczkach można przechwytywać w celu ich podawania w dalszym etapie. (Reprodukcja: I-Che Li/Rice University)
Hydrożel zmienia swój stan do postaci ciekłej pod wpływem sił ścinających występujących podczas przechodzenia przez igłę – jest to zjawisko zwane tiksotropią – a następnie powracają do swojej pierwotnej formy żelu w organizmie pacjenta. Leki zagnieżdżają się w przestrzeniach peptydowych i pozostają tam aż do chwili, gdy zostaną uwolnione działaniem hydrożelu. W laboratorium przetestowano hydrożele z wykorzystaniem leków nowotworowych, antybiotyków oraz leków przeciwzapalnych a także opisano sposób, w jaki leki zostają uwolnione w danej jednostce czasu.
Źródło: http://www.nanowerk.com/news2/biotech/newsid=43601.php
Tagi: nosnik, peptyd, hydrozel, lek, wlokno
wstecz Podziel się ze znajomymi








