- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Otrzymywanie olejków eterycznych metodą destylacji
Proces destylacji polega na ogrzaniu destylowanej cieczy do wrzenia, następnie na odprowadzeniu powstającej pary i ponownym jej skropleniu. Destylacja służy do oczyszczania cieczy i rozdzielania ich mieszanin. Praktyczne przeprowadzenie destylacji uzależnione jest od właściwości destylowanej cieczy. Bardzo ważna jest temperatury wrzenia danej substancji, która umożliwia przejście oczyszczanej substancji w stan pary bez jej jednoczesnego rozkładu. Pod uwagę należy również brać palność substancji oraz jej toksyczność. Dla substancji wysokowrzących (mogących ulec częściowemu lub całkowitemu rozkładowi) przed osiągnięciem temperatury wrzenia stosuje się tzw. destylację pod zmniejszonym ciśnieniem [6].
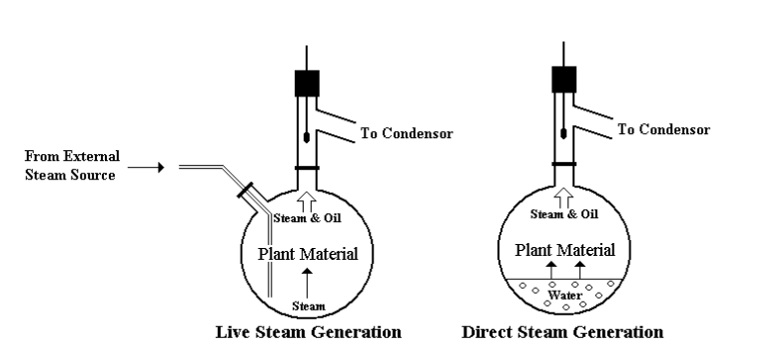
Proces destylacji z parą wodną opiera się na prawie Daltona, które mówi, że całkowita prężność pary nad roztworem kilku cieczy jest równa sumie ciśnień parcjalnych jego składników. Proces ten opisywany jest również prawem Raoult’a, gdzie „prężność pary danego składnika nad roztworem jest równa iloczynowi prężności pary tego składnika i jego ułamka molowego w roztworze” [6].
Dopóki istnieją obie fazy ciekłe, destylat będzie miał stały skład, a jego temperatura wrzenia będzie niższa niż każdego z jej składników. Dlatego też metoda ta wykorzystywana jest do destylacji cieczy lub ciał stałych (niskotopliwych), charakteryzujących się wysoką temperaturą wrzenia. Z jej wykorzystaniem możliwe jest również wydzielanie ze złożonych mieszanin składnika lotnego z parą wodną. I tu najlepszym przykładem takiego zastosowania jest wyodrębnianie olejków eterycznych z materiałów roślinnych [6].
Jeśli destyluje się z parą wodną znaczne ilości substancji, to para wodna wytwarzana jest i doprowadzana do układu z naczynia z podgrzewaną wodą (ma to zastosowanie w przypadku destylacji znacznych ilości substancji). W przypadku destylacji niewielkiej ilości substancji wystarczy dodać do kolby z destylowaną substancją wystarczającą ilość wody i energicznie ogrzewając, prowadzić destylację poprzez tzw. łapacz kropel [6]. W trakcie procesu, w kolbie umieszcza się roztwór –mieszanina lub związek stały z niewielką ilością wody, po czym łączy się ją z resztą zestawu. W następnym kroku do zestawu doprowadza się parę wodną, a kolba z materiałem poddawanym destylacji jest podgrzewana. Ma to na celu uniknięcie zbyt szybkiego nagromadzenia się w niej wody. Para wodna wraz z parami substancji lotnych z parą wodną dostają się do chłodnicy, w której powstaje tzw. kondensat. Kondensat ulega rozwarstwieniu na dwie fazy, a dalej odbierany jest w odbieralniku. W zestawie destylacji z łapaczem kropel, kolba przystosowana do destylacji z parą wodną zaopatrzona jest w nasadkę zwaną” łapaczem kropel”. Głównym zadaniem łapacz kropel jest zapobieganie przerzucaniu zawartości kolby do odbieralnika.
Wśród minusów metody destylacji z parą wodną należy wymienić konieczność oddzielenia właściwego destylatu od wody, co w przypadku ciał stałych jest proste (odsączenie i wysuszenie), jednak przysparza pracy w przypadku cieczy, gdyż proces ten wymaga przeprowadzenia dość pracochłonnej ekstrakcji [6].

Zdj. https://infohost.nmt.edu/~jaltig/SteamDistill.pdf
Tagi: olejki eteryczne, aromaty, destylacja, substancje lotne, wytaczanie, maceracja, ekstrakcja, absorpcja, pomada, absolut, konkret
wstecz Podziel się ze znajomymi









Recenzje