- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Białko C-reaktywne jako marker procesów zapalnych
Największe zmiany stężenia CRP we krwi występują w zakażeniach bakteriami Gram-ujemnymi, które prowadzą do rozwoju sepsy. Zakażenia wywołane bakteriami Gram-dodatnimi oraz grzybami chorobotwórczymi powodują mniejszy wzrost stężenia CRP we krwi. Podwyższenie poziomu CRP wykazano również w zaawansowanych postaciach zapalenia przyzębia, co potwierdzono prowadząc badania doświadczalne na zwierzętach [1].
High-sensitivity CRP (hs-CRP) oraz mCRP
Działanie oraz wpływ na organizm białka C-reaktywnego istotnie zależy od struktury cząsteczki CRP. Na początku lat 80-tych ubiegłego wieku odkryto zmodyfikowaną postać białka C-reaktywnego, określaną jako mCRP). Zarówno CRP w wersji natywnej (tj. pentamera zbudowanego z 5 identycznych podjednostek o masie 23 kDa każda; CRP), jak i zmodyfikowanej (tj. monomer; mCRP) występuje naturalnie w ustroju. Na podstawie badań immunohistochemicznych ustalono, że mCRP w odróżnieniu od CRP, występuje w prawidłowych ludzkich tkankach. Świadczy o tym jego wysoka ilość w ścianach naczyń krwionośnych.
Na podstawie zebranych danych ustalono, że mechanizm powstawania mCRP polega na dysocjacji pentamerów CRP do pojedynczych jednostek. Dysocjacja musi zachodzić w określonych warunkach, np. w środowisku denaturującym i po związaniu się natywnego białka CRP z błoną komórkową. Utworzone monomery z kolei, podlegają zmianom konformacyjnym ze zmianą struktury drugorzędowej, co z kolei powoduje, że nieodwracalnie zmodyfikowana postać CRP i natywne CRP różnią się między sobą cechami fizyko-chemicznymi (w tym ładunkiem, masą cząsteczkową, rozpuszczalnością, a także odmienną charakterystyką antygenową (tzw. „neo-CRP”) oraz zmienioną aktywnością biologiczną. Wykazano również, że cząsteczka mCRP jest bardziej wrażliwa na proteolizę niż natywne CRP. Z kolei badania porównawcze przeprowadzone in vitro nad wpływem CRP i mCRP na regulację funkcji neutrofilów oraz komórek śródbłonka ujawniły różnice w ich aktywności biologicznej [15].
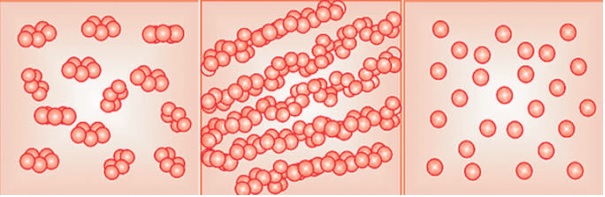
Zdjęcie: Typy strukturalne białka CRP (obserwowane na powierzchni błon fosfolipiowych, zależne od warunków inkubacji CRP z błonami fosfolipidowymi).
Od lewej:
A)Struktura pierścieniowa- typowa postać białka C-reaktywnego charakteryzującą natywne CRP
B)Struktura typu włókienkowego – powstaje w wyniku zlepiania się ze sobą pentamerów natywnego CRP
C)Cząsteczki zdysocjowane do małych globularnych monomerów [15].
Oznaczanie stężenie CRP wykorzystywane jest do oceny ryzyka tzw. incydentów sercowo-naczyniowych, ponieważ ogólnie znane jest powiązanie między poziomem CRP we krwi a ryzykiem wystąpienia chorób wieńcowych. W tym celu wykonywany jest wysokoczuły test, tzw. hs-CRP, który pozwala na oznaczenie stężeń białka w zakresie 0,5 – 10 mg/l. Większość przeprowadzonych badań wskazuje, że ryzyko chorób serca rośnie wraz z poziomem hs-CRP. Jeżeli oznaczone stężenie białka jest niższe niż 1,0 mg/l- ryzyko jest niewielkie. Stężenie pomiędzy 1,0 – 3,0 mg/l wskazuje na średnie ryzyko rozwoju chorób serca, z kolei poziomy wyższe 3,0 mg/l oznaczają duże zagrożenie rozwinięcia się chorób serca (np. zawału mięśnia sercowego) [5].
Autor: Zuzanna Koperwas
Literatura:
[1]. Dorocka-Bobkowska B., Łukaszewska-Kuska M., Zozulińska-Ziółkiewicz D., Wierusz-Wysocka B., 2011. Białko C-reaktywne u chorych na cukrzycę typu 2 ze stomatopatią protetyczną. PROTET. STOMATOL., 2011, LXI, 1, 5-12. http://prot.stomat.net/upload/articles/13/1263.pdf
[2]. Oliveira C., et al., 2012. Influence of periodontal therapy on C-reactive protein level: a systematic review and meta-analysis J. Appl. Oral Sci. vol.20 no.1 Bauru Jan./Feb. 2012. http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1678-77572012000100002
[3]. Kopczyński P., Matthews-Kozanecka M., Flieger R., 2013. Wartość oznaczania białka c-reaktywnego w diagnostyce procesów zapalnych z uwzględnieniem stomatologii – przegląd piśmiennictwa. Nowiny Lekarskie 2013, 82, 3, 243–245. http://www.nowinylekarskie.ump.edu.pl/uploads/2013/3/243_3_82_2013.pdf
[4]. Jasińska A., Kraszula Ł., Eusebio M.O., Kupczyk M., Kuna P., Pietruczuk M., 2014. Ocena stężeń wybranych adipocytokin i białka C-reaktywnego (CRP) u chorych na astmę oskrzelową. diagnostyka laboratoryjna Journal of Laboratory Diagnostics Diagn Lab 2014; 50(3): 213-220. http://www.diagnostykalaboratoryjna.eu/journal/DL_3_2014;_213-220.pdf
[5]. Cicetti F., 2011. Healthy Geezer: C-Reactive Protein – Cardiac. http://www.hamptons.com/Lifestyle//For-Your-Health/15821/Healthy-Geezer-C-Reactive-Protein-Cardiac.html?sectionName=Outdoors-And-Fitness&columnName=For-Your-Health&articleID=15821#.VgfS3SsdEQ0
[6]. Rhodes B., Fὔrnrohr B.G., Vyse T.J., 2011. C-reactive protein in rheumatology: biology and genetics. Nature Reviews Rheumatology 7, 282-289 (May 2011). http://www.nature.com/nrrheum/journal/v7/n5/full/nrrheum.2011.37.html
[7]. http://themedcircle.com/c-reactive-protein-crp/
[8]. http://chemklin.sum.edu.pl/uploaded/Bia%C5%82ko%20C-reaktywne%20%28CRP%29.pdf
[9]. Hengst J.H., 2003. The Role of C-Reactive Protein in the Evaluation and Management of Infants With Suspected Sepsis. Adv Neonatal Care. 2003;3(1). http://www.medscape.com/viewarticle/450937_3
[10]. Stasik Z., Skotnicki P., Nowak-Sadzikowska J., Kanty Kulpa J., 2008. Białko C-reaktywne u chorych na nowotwory złośliwe. NOWOTWORY Journal of Oncology, 2008, volume 58. Number 5 • 441–446.
[11]. Orzędała-Koszel U., Bachanek T., Karczmarek-Borowska B., 2005. Białko C−reaktywne jako czynnik diagnostyczny w stanach zapalnych jamy ustnej i chorobach nowotworowych. Dent. Med. Probl. 2005,
42, 1, 131–136. http://www.dmp.am.wroc.pl/artykuly/DMP_2005421131.pdf
[12]. Kucharska A., 2010. Ocena stężenia białka C-reaktywnego i ultrasonograficznych wykładników miażdżycy u pacjentów z otyłością i zespołem metabolicznym. Praca doktorska. http://www.wbc.poznan.pl/Content/167192/index.pdf
[13]. Nowak J., Boncler M., Watała C., 2014. Zastosowanie testów point-of-care do oznaczania białka C-reaktywnego w podstawowej opiece zdrowotnej. diagnostyka laboratoryjna Journal of Laboratory Diagnostics Diagn Lab 2014; 50(1): 53-60
[14]. http://www.piccoloxpress.com/wp-content/uploads/foreign/Metlyte-Plus-CRP-PL.pdf
[15]. Boncler M., Luzak B., Watała C., 2006. Znaczenia białka C-reaktywnego w patofizjologii miażdżycy. Postepy Hig Med Dosw. (online), 2006; 60: 538-546
[16]. http://www.glukopharma.eu/testy/CRP-30.pdf
Tagi: marker stanu zapalnego, białko C-reaktywne, CRP, High-sensitivity CRP, hs-CRP, mCRP, testy point-of-care, białko, metoda immunoturbidymetryczna, przeciwciała monoklonalne, anty-CRP, cytokiny prozapalne
wstecz Podziel się ze znajomymi









Recenzje