- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Białko C-reaktywne jako marker procesów zapalnych
Białko C-reaktywne (ang. C-reactive protein, CRP) jest jednym z najbardziej czułych parametrów ostrej fazy przy uszkodzeniach tkanek lub zapaleniach. Białko to aktywuje układ dopełniacza (zespół kilkudziesięciu białek obecnych w osoczu, biorących udział w nieswoistej odpowiedzi immunologicznej) jako reakcję na stan zapalny [8]. W przebiegu zapalenia lub procesu martwiczego docodzi do szybkiego wzrastania stężenia CRP, z kolei krótki okres półtrwania tego białka (wynoszący średnio ok. 19 godzin), sprawia, że stężenie zależy głównie od jego syntezy i szybko maleje po ustaniu czynnika sprawczego [1]. Pomiar stężenia białka C-reaktywnego (CRP) uznawany jest w praktyce klinicznej za wrażliwy marker stanu zapalnego [6]. Analiza specyficznego CRP (high-sensitivity CRP, hs-CRP) pozwala z kolei na określenie ryzyka wystąpienia choroby niedokrwiennej serca [7]. Najczęściej stężenie białka oznacza się w surowicy lub osoczu metodą immunochemiczną. Na stężenie białka może wpływać kilka czynników:
- wiek, płeć, pora roku
- aktywność fizyczna, palenie tytoniu, BMI
- cukrzyca, nadciśnienie tętnicze
- HZT (hormonalna terapia zastępcza) [12].
CRP jest nieswoistym markerem stanu zapalnego w organizmie, wywołanego przez zakażenia bakteryjne, wirusowe, pasożyty, choroby układowe tkanki łącznej, zapalenia jelit i trzustki, bądź zawał mięśnia sercowego czy nowotwory złośliwe [12].
Białko CRP zostało po raz pierwszy odkryte przez Tillet’a i Francis’a w 1930 roku (Uniwersytet Rockefellera) w surowicy podczas badania dorosłych pacjentów z rozpoznaniem ostrego pneumokokowego zapalenia płuc. Badacze zaobserwowali reakcję precypitacji (strącania) zachodzącą pomiędzy CRP i ścianą komórkową (C-polisacharydem) bakterii pneumokoków. Jak później stwierdzono, reakcja ta jest wynikiem wiązania CRP do C-polisacharydu w obecności wapnia, w wyniku czego dochodzi do utworzenia kompleksów CRP-ligand [9].
Struktura białka C-reaktywnego
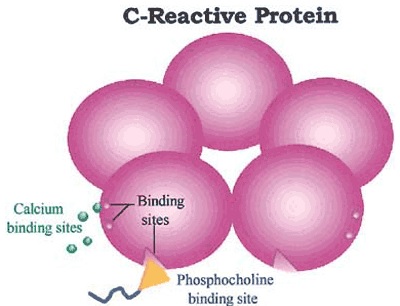
Białko C-reaktywne (CRP, tzw. białko ostrej fazy) jest glikoproteiną, której synteza zachodzi głównie w hepatocytach wątroby. Cały proces produkcji tego białka odbywa się w odpowiedzi na działanie cytokin prozapalnych (przede wszystkim IL-6), interleukiny-1β (IL-1β), czynnika martwicy guza (TNFα) oraz innych mediatorów stanu zapalnego [1]. Gen dla CRP (zawierający jeden intron) zlokalizowany jest w obrębie chromosomu 1 w jednej kopii. Pod względem budowy cząsteczka białka zbudowana jest z 206 aminokwasów, które agregują do formy pentametrycznej, a ciężar cząsteczkowy wynosi ok. 118 000 kDa (kilo-Daltona). Białko tworzy strukturę o kształcie pierścienia, który zbudowany jest z 5 identycznych niezawierających reszt węglowodanowych polipeptydów. Każdy z nich zawiera 206 reszt aminokwasowych, połączonych wiązaniami niekowalencyjnymi. Prawidłowe stężenie CRP u ludzi zdrowych nie powinno przekraczać 3 mg/l, z kolei w stanach zapalnych jego stężenie może wzrosnąć nawet 1000-krotnie, osiągając maksymalne stężenie po upływie 24–48 godzin. CRP powraca do wartości wyjściowych w ciągu 7 do 12 dni, dzięki czemu białko CRP uznawane jest za istotny marker toczącej się reakcji zapalnej w organizmie. Stężenie CRP jedynie w małym stopniu modyfikowane jest przez hormony lub inne substancje biologiczne i leki przeciwzapalne [3], [10].
Zdjęcie: Pentameryczna budowa białka CRP (z miejscem wiązania wapnia i fosfocholiny) [9].
Oznaczanie białka C-reaktywnego
Zasada metody:
Białko CRP w surowicy powoduje aglutynację cząsteczek lateksu opłaszczonych przeciwciałami skierowanymi przeciwko ludzkiemu białku C-reaktywnemu. Zachodząca aglutynacja jest proporcjonalna do stężenia CRP w próbce. Wartość może być zmierzona metodą turbidymetryczną [8].
Odczynniki wykorzystywane do oznaczenia:
Odczynnik A: Bufor glicynowy 0,1 mol/L, azydek sodu 0,95g/l, pH=8,6
Odczynnik B: zawiesina cząsteczek lateksu opłaszczonych przeciwciałami przeciwko ludzkiemu CRP, azydek sodu 0,95 g/l.
Odczynnik roboczy: odczynnik A + odczynnik B
Standard (S) CRP: surowica ludzka (stężenie białka CRP podane jest na etykiecie fiolki). Wartość stężenia zgodna ze Standardowym Materiałem Referencyjnym.
Materiał do badań: surowica pobrana zgodnie ze standardowymi procedurami. Białko CRP jest stabilne w surowicy przez 7 dni w temp. 2-8⁰C [8].
Aparatura:
- Termostatowana łaźnia wodna (nastawiona na 37⁰C)
- Analizator, spektrofotometr lub fotometr
Wykonanie oznaczenia:
- Doprowadzić odczynnik roboczy i aparat pomiarowy do temp. 37⁰C
- Wyzerować aparat wobec wody destylowanej
- Do kuwety pomiarowej odpipetować: 1,0 ml odczynnika roboczego oraz 7 µl standardu (S) lub próby badanej.
- Próbkę dokładnie wymieszać, po czym włożyć kuwetę do aparatu. Rozpocząć pomiar czasu.
- Po upływie 10 sekund należy odczytać wartość absorbancji (A1) próbki przy 540 nm. Kolejny odczyt absorbancji (A2) dokonać po upływie 2 minut od momentu rozpoczęcia pomiaru czasu.
Na podstawie otrzymanych wyników należy obliczyć stężenie CRP w próbce wg poniższego wzoru:
Cpróbki (mg/l) = (A2 – A1) próbki / (A2 – A1) standard x Cstandardu [8].
Metody oznaczania białka C-reaktywnego
Pomimo, iż od momentu odkrycia białka C-reaktywnego zauważono jego ogromny potencjał w diagnostyce klinicznej, jego oznaczanie stosunkowo długo nie znajdowało szerszego zastosowania w praktyce. Jedną z przyczyn takiego stanu był brak odpowiednio czułych metod analitycznych, które pozwalałyby na jego stosunkowo szybką i łatwą identyfikację. Dostępne testy pozwalały jedynie na wykonywanie oznaczeń jakościowych, których wykorzystanie w celach diagnostycznych było znacznie ograniczone. Wraz z rozwojem metod analitycznych wprowadzono testy do ilościowego oznaczania białka CRP, jednakże pozwalały one jedynie na wykrywanie obecności tego białka w surowicy krwi w stężeniach wyższych niż 10 mg/l. Oznaczanie bardzo niskich stężeń białka CRP stało się możliwe dopiero dzięki zautomatyzowaniu metody immunonefelometrii oraz opracowaniu czułego testu high-sensitive CRP (hs-CRP), wykorzystującego swoiste przeciwciała monoklonalne i wzmocnienie lateksowe [10]. W wielu badaniach białko C-reaktywne oceniane jest w surowicy za pomocą wysoce czułej metody immunoturbidymetrycznej, w której również wykorzystywane są przeciwciała opłaszczone na lateksie (testy lateksowe), skierowane przeciwko ludzkiemu CRP [1]. Metody te pozwalają na precyzyjne ocenienie dynamiki zmian stężenia CRP [11].
Metoda immunoturbidymetryczna polega na obserwacji zmian rozproszenia i przepuszczalności światła. Wykonanie testu trwa około godziny. Zasada oznaczenia polega na specyficznej reakcji białka z przeciwciałami skierowanymi przeciwko ludzkiemu CRP, które osadzone są na cząstkach lateksu. W wyniku reakcji tworzą się nierozpuszczalne kompleksy (tzw. agregaty) cząstek lateksu, a w miarę tworzenia takich kompleksów zwiększa się przepuszczalność światła związana bezpośrednio ze stężeniem białka w badanej próbce [13].









Recenzje