- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Technika mikromacierzy DNA
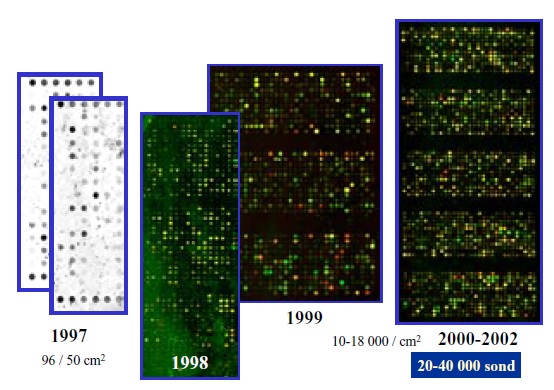
Zdjęcie: Rozwój techniki mikromacierzy na przestrzeni lat [6].
W typowym eksperymencie mikromacierzy wyróżnia się 4 główne etapy:
1) Przygotowanie i znakowanie próbek
2) Hybrydyzacja
3) Mycie
4) Otrzymanie obrazu i analiza danych [11].
Sondy do mikromacierzy
W przypadku, gdy w badaniu nie korzystamy z macierzy komercyjnej, zaprojektowanie zestawu sond staje się głównym zadaniem w eksperymencie. Odpowiednio dobrane sondy są następnie umieszczane na macierzy. Niezbędnym warunkiem uzyskania wiarygodnych wyników w eksperymencie mikromacierzowym jest wysoka czułość oraz specyficzność zaprojektowanych sond. Każda sonda musi specyficznie rozpoznawać fragment genomu lub transkryptomu powstałego podczas ekspresji informacji genetycznej [12].
Wysoka czułość zastosowanych sond oznacza, że dana sonda z wysokim prawdopodobieństwem musi hybrydyzować z określonym fragmentem DNA/RNA, którego obecność w badanej próbie ma wykrywać. Sonda musi być w pełni komplementarna do wybranego fragmentu sekwencji docelowej. Przez specyficzność sondy rozumie się minimalizowanie prawdopodobieństwa jej hybrydyzacji do sekwencji innej niż docelowa. Sonda powinna charakteryzować się jak najmniejszym stopniem komplementarności do wszystkich sekwencji, które mogą występować w badanej próbie (z wyjątkiem sekwencji docelowej) [12].
Najczęściej podczas projektowania sond stosowane są następujące reguły:
- „zawartość danego nukleotydu w sondzie nie może stanowić więcej niż 50% sekwencji,
- fragmenty składające się z nukleotydów jednego rodzaju nie powinny przekraczać 25% długości sondy,
- zawartość nukleotydów GC powinna mieścić się w granicach od 30 do 70%,
- oligonukleotydy będące sondami oraz komplementarne do nich sekwencje docelowe nie powinny tworzyć stabilnych struktur drugorzędowych,
- długość ciągłego fragmentu sondy komplementarnego do sekwencji niebędącej sekwencją docelową nie powinna przekraczać 15 nukleotydów,
- stopień komplementarności do sekwencji niebędącej sekwencją docelową nie powinien przekraczać 75%” [12].
Tagi: mikromacierze, oligonukleotydy, sondy, otwrotna transkrypcja, PCR
wstecz Podziel się ze znajomymi









Recenzje