- Biochemia
- Biofizyka
- Biologia
- Biologia molekularna
- Biotechnologia
- Chemia
- Chemia analityczna
- Chemia nieorganiczna
- Chemia fizyczna
- Chemia organiczna
- Diagnostyka medyczna
- Ekologia
- Farmakologia
- Fizyka
- Inżynieria środowiskowa
- Medycyna
- Mikrobiologia
- Technologia chemiczna
- Zarządzanie projektami
- Badania kliniczne i przedkliniczne
Rośliny jako źródło leków przeciwnowtorowych
Poliaminy
Poliaminy są grupą związków o prostej budowie chemicznej, które w swojej strukturze posiadają grupy aminowe. Ponadto są zaliczane do grupy fitohormonów roślinnych, ze względu na fakt, że wykazują typowe dla tych hormonów właściwości. Poliaminy występują także w organizmach zwierzęcych. Wśród tych związków znajduje się putrescyna (1,4-diaminobutan), która jest prekursorem innych poliamin, takich jak spermina i spermidyna. Do tej grupy związków zalicza się również kadawerynę (Zdrojewicz i Lachowski, 2014). Bezpośrednim prekursorem poliamin jest aminokwas, arginina. Najważniejszą rolę, jaką pełni ten aminokwas to udział w procesach cyklu mocznikowego. Pozbawienie komórek prawidłowo rozwijających się argininy sprawia, że komórki te wykorzystują cytrulinę do syntezy tego aminokwasu. W przypadku komórek nowotworowych brak argininy powoduje ich obumieranie. Jednakże, omega-hydroksy-L-arginina podana egzogennie do hodowli komórek raka gruczołu sutkowego człowieka (MDA-MB-468) powoduje aktywację kaspazy 3, a tym samym aktywuje proces apoptozy (Fig. 1; Graboń, 2006). Spośród poliamin największą uwagę skupia się na putrescynie. W prawidłowo rozwijających się komórkach putrescyna uczestniczy w regulacji proliferacji i cyklu komórkowego, poprzez kontrolowanie przejścia pomiędzy poszczególnymi fazami cyklu, a także w prawidłowym przebiegu programowanej śmierci komórkowej. Jedną z właściwości jest ich funkcja protekcyjna, zabezpieczająca materiał genetyczny przed działaniem czynników kancerogennych. Jest to możliwe dzięki temu, że poliaminy występują w postaci kationu dodatniego, który ma zdolność łączenia się z komórkowymi makromolekułami, takimi jak ujemnie naładowana cząsteczka DNA. Putrescyna wpływa także na ograniczenie migracji i rozprzestrzeniania się komórek nowotworowych. Czynnikiem odwracającym tę sytuację jest związek DFMO-α (difluorometylornityna/eflornityna), który obniża poziom putrescyny i zatrzymuje cykl komórkowy komórek nowotworowych w fazie G1 (Zdrojewicz i Lachowski, 2014). Ponadto, poprzez ograniczenie dostępności substancji pokarmowych, DFMO-α hamuje angiogenezę w ludzkich komórkach raka żołądka oraz komórkach czerniaka, co prowadzi do obumierania tych komórek (Graboń, 2006).
Cytokininy
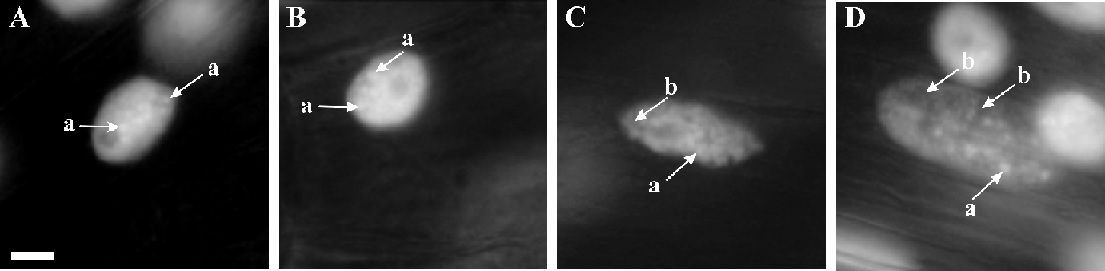
Niezwykle interesującą grupą związków w zakresie kontroli PCD są cytokininy (Jabłońska-Trypuć i Czerpak, 2009). Są to hormony roślinne (Kopcewicz i Lewak, 2002), które kontrolują zarówno proces apoptozy nowotworów zwierzęcych, jak i ludzkich (Jabłońska-Trypuć i Czerpak, 2009) oraz PCD u roślin (Fig. 2; Carimi i współaut., 2003; Doniak i współaut., 2014). W tym zakresie najsilniejszą aktywność wykazują rybozydy cytokinin oraz BAP (benzyloaminopuryna). BAP ma zdolność do hamowania niektórych ludzkich kinaz białkowych włącznie z CDK, przez co może wpływać ograniczająco na proliferację komórek i aktywację apoptozy, co stanowi, jak już wiele razy wspomniano, jeden z głównych celów terapii przeciwnowotworowej (Jabłońska-Trypuć i Czerpak, 2009). Inne cytokininy wywołują podobne właściwości, z tym jednak, że istnieje konieczność stosowania wyższych stężeń tych związków (Carimi i współaut., 2003). Kinetyna oraz izopentenyloadenina (IPA) i benzyloadenina (BA) efektywnie hamują rozwój komórek i indukują redukcję MTT oraz morfologiczne zmiany w dojrzałych granulocytach białaczki szpikowej (Minorsky, 2003). Natomiast rybozydy cytokinin efektywnie hamują rozwój i indukują apoptozę, ograniczając zawartość komórkowego ATP oraz zaburzając potencjał błonowy mitochondriów i akumulując ROS (Ishii i współaut., 2002). W przypadku komórek roślinnych wykazano, że BAP hamuje proliferację i indukuje programowaną śmierć komórek kultur Daucus carota L. i Arabidopsis, której przejawem jest fragmentacja jądrowego DNA (Carimi i współaut., 2003). Podobnie, choć z innymi przejawami procesu, działa kinetyna (Fig. 2; Doniak i współaut., 2014).
Fig. 2. Morfologiczne przejawy kondensacji (A,B), degradacji i ubytku chromatyny (C,D) podczas śmierci komórkowej indukowanej kinetyną obserwowane na poziomie jądra komórkowego komórek kory pierwotnej korzeni Vicia faba ssp. minor (bobik) podobne do tych, jakie obserwuje się podczas apoptozy u organizmów zwierzęcych (obserwacje własne). a – kondensacja chromatyny, b – degradacja i ubytek chromatyny; skala = 10 µm, dotyczy wszystkich zdjęć.
wstecz Podziel się ze znajomymi









Recenzje